
Estrutura, função e valores normais da imunoglobulina D

O imunoglobulina D (IgD), descoberta em 1965, é uma imunoglobulina de superfície encontrada (junto com a IgM) na membrana dos linfócitos B (mIgD) antes de sua ativação.
Tem a função de receptor inicial de antígenos. IgD também está livre no plasma graças à sua secreção (sIgD). Tem um peso molecular de 185.000 Daltons e representa cerca de 1% das imunoglobulinas de um organismo.
Índice do artigo
- 1 O que são imunoglobulinas?
- 2 Estrutura
- 3 Função e doenças
- 3.1 sIgD
- 3,2 mIgD
- 3,3 linfócitos B
- 3.4 Sistema Imuneinflamatório
- 4 valores normais
- 4.1 Concentração sérica
- 4.2 Valores sanguíneos
- 5 referências
O que são imunoglobulinas?
Imunoglobulinas ou anticorpos são glicoproteínas globulares complexas altamente específicas sintetizadas por linfócitos B, células responsáveis pela resposta imune no corpo dos animais..
As imunoglobulinas interagem com moléculas que o corpo identifica como não próprias ou antígenos. Qualquer substância capaz de ativar a resposta imune no corpo é chamada de antígeno..
A família de moléculas de anticorpos Ig inclui aquelas que circulam no plasma sanguíneo e aquelas na superfície dos linfócitos B antes de sua ativação..
Existem cinco tipos de imunoglobulinas: IgG, IgD, IgE, IgA e IgM (identificada em humanos, camundongos, cães, répteis, peixes, entre outros), que se diferenciam estruturalmente por suas regiões constantes na cadeia pesada. Essas diferenças dão a eles propriedades funcionais particulares.
Os anticorpos atuam como sensores específicos para antígenos. Com eles, eles formam complexos que iniciam uma cascata de reações típicas do sistema imunológico. As etapas gerais deste processo são: reconhecimento, diferenciação de linfócitos específicos e finalmente a etapa efetora.
Estrutura
Todos os anticorpos são moléculas polipeptídicas complexas em forma de "Y". Eles são compostos por quatro cadeias polipeptídicas, duas delas cadeias leves (curtas) idênticas de cerca de 214 aminoácidos cada, e as outras duas cadeias pesadas (longas) também idênticas entre si, o dobro de aminoácidos. Uma ligação dissulfeto liga uma cadeia leve a uma cadeia pesada.
Ambos os tipos de cadeias possuem regiões constantes (características do tipo de anticorpo e da espécie a que o organismo pertence), onde a sequência de aminoácidos se repete de uma molécula para outra, e também possuem regiões variáveis de aproximadamente 100 aminoácidos em comprimento..
Uma ponte dissulfeto (ligação do tipo covalente) une cada cadeia leve a uma cadeia pesada e, por sua vez, uma ou duas dessas ligações podem unir as duas cadeias pesadas.
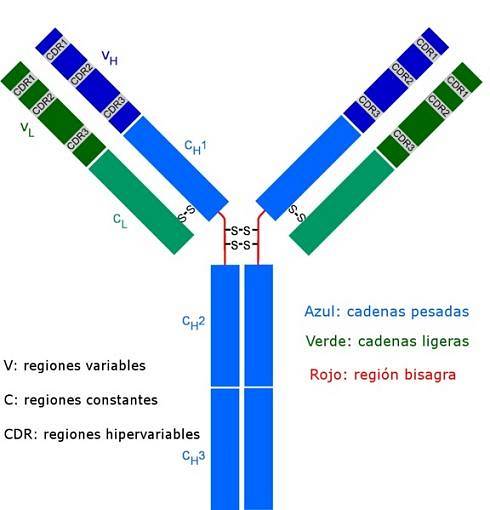
Esses locais são aqueles que se ligam como uma luva a uma região particular do antígeno, epítopo ou determinante antigênico específico. A estabilização desta interação ocorre graças a inúmeras ligações não covalentes.
Essas sequências de CDR são altamente variáveis entre os anticorpos, gerando especificidade para diferentes tipos de antígenos..
Em relação às particularidades da imunoglobulina D, sabe-se que ela apresenta grande diversidade entre os vertebrados. Em termos gerais, é composto por duas cadeias pesadas delta e duas cadeias leves. A IgD está livre no soro ou ligada aos linfócitos B por meio de um receptor Fc..
Função e doenças
Como o IgD foi evolutivamente preservado de peixes cartilaginosos (que povoaram o planeta há cerca de 500 milhões de anos) para os humanos, acredita-se que sirva a funções imunológicas vitais.
Apesar disso, tem sido a menos estudada das imunoglobulinas, para as quais as funções específicas de sIgD no soro ainda não são conhecidas com exatidão, embora várias funções tenham sido propostas para mIgD.
sIgD
Uma das causas do recente interesse no estudo da sIgD tem sido o achado de níveis elevados dessa Ig em algumas crianças com febre periódica. Por sua vez, outro fator de interesse é sua utilidade no monitoramento de mielomas..
Acredita-se que SIgD desempenhe um papel no sangue, nas secreções da mucosa e na superfície das células efetoras imunes inatas, como os basófilos.
Eles são altamente reativos contra patógenos do sistema respiratório e seus produtos de excreção. Foi relatado que IgD aumenta a imunidade da mucosa, graças ao seu efeito nas bactérias e vírus presentes.
mIgD
Em relação ao mIgD, é considerado um receptor de antígeno de membrana para linfócitos B, o que favorece a maturação celular. Por sua vez, acredita-se que seja um ligante para receptores de IgD na imunorregulação de células T auxiliares..
Linfócitos B
Acredita-se que os linfócitos B produtores de IgD representem uma linhagem celular particular denominada linfócitos B-1. Estes são linfócitos auto-reativos que escaparam da deleção clonal.
Os autoanticorpos gerados por esses linfócitos reagem com o ácido desoxirribonucléico ou DNA (de fita simples e dupla), com os receptores celulares, as membranas celulares dos glóbulos vermelhos e o tecido epitelial..
É assim que eles geram doenças autoimunes, como lúpus eritematoso sistêmico, miastenia Gravis, anemia hemolítica autoimune e púrpura trombocitopenia idiopática.
Sistema Imunoinflamatório
Sabe-se também que os IgDs estão envolvidos na orquestração de um sistema que interfere entre os sistemas imunológico e inflamatório: altas concentrações de IgD estão relacionadas a doenças autoinflamatórias (síndrome de hiperimunoglobulemia D, HIDS ou hiper-IgD).
Por exemplo, em pacientes com doenças autoimunes, como artrite reumatóide, são encontrados valores elevados de sIgD e mIgD. Portanto, acredita-se que essa condição contribua para a patogênese da doença.
As possíveis funções desse anticorpo em células mononucleares do sangue periférico (PBMC) desses pacientes estão atualmente sendo estudadas. Tudo isso levou a considerar que o IgD poderia ser um potencial alvo imunoterapêutico no tratamento da artrite reumatóide.
Valores normais
O sIgD em indivíduos normais varia amplamente, o que torna difícil estabelecer um intervalo de referência preciso para suas concentrações normais. Alguns estudos mostraram que esta variação é particularmente influenciada por:
- A sensibilidade da técnica de detecção aplicada - tanto por radioimunoensaios (RIA), imunoensaios enzimáticos (EIA) e a mais comumente usada em laboratórios clínicos que é a radioimunodifusão (RID)-.
- A ausência de um único método universal estipulado para a detecção de IgD.
- Fatores hereditários, raça, idade, sexo, estado de gravidez, tabagismo, entre outros
Alguns especialistas chegam a considerar que a análise rotineira de IgD não se justifica, pois seu papel específico está longe de ser elucidado e os custos de sua análise em laboratório clínico são elevados. Só seria justificado em casos de pacientes com IgD monoclonal sérico ou suspeita de ter SHID.
Concentração sérica
Por outro lado, sabe-se que sIgD geralmente apresenta concentração sérica menor que a de IgG, IgA e IgM, mas maior que a concentração de IgE..
Além disso, por ter meia-vida de 2 a 3 dias, a concentração plasmática é inferior a 1% da imunoglobulina total no soro. Algumas pesquisas indicam que representa 0,25% do total de imunoglobulinas séricas.
Valores sanguíneos
Entre os valores relatados de sIgD no sangue, em recém-nascidos foi de 0,08 mg / L (determinado por RIA), em bebês e adultos varia de valores indetectáveis a 400 mg / L (dependendo da idade e indivíduos de cada Individual).
Em adultos normais, foram relatados como médias normais 25; 35; 40 e 50 mg / L. Em termos gerais, a concentração sérica média para adultos saudáveis foi relatada como 30 mg / L (determinada por RID)..
No entanto, conforme discutido neste artigo, existem vários fatores que impedem o estabelecimento de uma faixa de valores normais padrão..
Referências
- Chen, K. e Cerutti, A. (2011). A função e regulação da imunoglobulina D. Opinião atual em imunologia, 23 (3), 345-52.
- Harfi, A. H. e Godwin, J.T. (1985). Níveis séricos normais de IgG, IgA, IgM, IgD e IgE na Arábia Saudita. Annals of Saudi Medicine, Vol 5, No. 2.99-104. doi: 10.5144 / 0256-4947.1985.99
- Josephs, S.H. e Buckley, R.H. (1980). Concentrações séricas de IgD em bebês, crianças e adultos normais e em pacientes com IgE elevada. The Journal of Pediatrics, Vol. 96, No. 3, pp 417-420.
- Vladutiu, A.O. (2000). Imunoglobulina D: propriedades, medição e relevância clínica. Imunologia clínica e diagnóstica laboratorial, 7(2), 131-40.
- Voet, J.G. e Voet, W.P.D. (2005). Fundamentos de Bioquímica: Lyfe at the Molecular Level. Wiley. pp 1361.
- Wu, Y., Chen, W., Chen, H., Zhang, L., Chang, Y., Yan, S., Dai, X., Ma, Y., Huang, Q. e Wei, W. ( 2016). A imunoglobulina D secretada elevada aumentou a ativação das células mononucleares do sangue periférico na artrite reumatóide. PloS um, 11 (1). doi: 10.1371 / journal.pone.0147788



Ainda sem comentários