
Estrutura, tipos e funções de imunoglobulinas
As imunoglobulinas São moléculas que formam os linfócitos B e as células plasmáticas que colaboram com a defesa do organismo. Eles consistem em uma biomolécula de glicoproteína pertencente ao sistema imunológico. São uma das proteínas mais abundantes no soro sanguíneo, depois da albumina..
Anticorpo é outro nome para imunoglobulinas, e são consideradas globulinas devido ao seu comportamento na eletroforese do soro sanguíneo que as contém. A molécula de imunoglobulina pode ser simples ou complexa, dependendo se sua apresentação é monomérica ou polimerizada..

A estrutura comum das imunoglobulinas é semelhante à letra "Y". Existem cinco tipos de imunoglobulinas que apresentam diferenças morfológicas, funcionais e de localização no corpo. As diferenças estruturais dos anticorpos não estão na forma, mas na composição; cada tipo tem um objetivo específico.
A resposta imune promovida pelas imunoglobulinas é muito específica e é um mecanismo altamente complexo. O estímulo para sua secreção pelas células é ativado na presença de agentes estranhos ao organismo, como bactérias. A função da imunoglobulina será ligar-se ao elemento estranho e eliminá-lo.
As imunoglobulinas ou anticorpos podem estar presentes no sangue e na superfície membranosa dos órgãos. Essas biomoléculas representam elementos importantes dentro do sistema de defesa do corpo humano..
Índice do artigo
- 1 Estrutura
- 1.1 Cadeias pesadas
- 1.2 Cadeias leves
- 1.3 Segmentos Fc e Fab
- 2 tipos
- 2.1 Imunoglobulina G (IgG)
- 2.2 Imunoglobulina M (IgM)
- 2.3 Imunoglobulina A (IgA)
- 2.4 Imunoglobulina E (IgE)
- 2,5 Imunoglobulina D (IgD)
- 2.6 Mudança de tipo
- 3 funções
- 3.1 Funções gerais
- 3.2 Funções específicas
- 4 referências
Estrutura
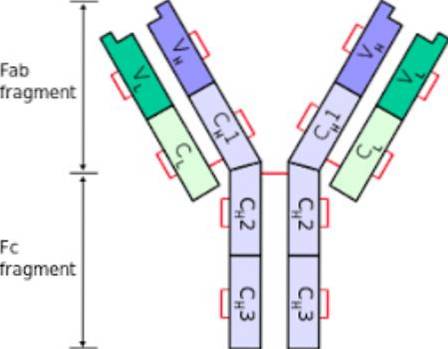
A estrutura dos anticorpos contém aminoácidos e carboidratos, os oligossacarídeos. A presença predominante de aminoácidos, sua quantidade e distribuição é o que determina a estrutura da imunoglobulina..
Como todas as proteínas, as imunoglobulinas apresentam estruturas primárias, secundárias, terciárias e quaternárias, determinando seu aspecto típico..
Em relação ao número de aminoácidos que apresentam, as imunoglobulinas possuem dois tipos de cadeia: cadeia pesada e cadeia leve. Além disso, de acordo com a sequência de aminoácidos em sua estrutura, cada uma das cadeias possui uma região variável e uma região constante..
Correntes pesadas
As cadeias pesadas das imunoglobulinas correspondem a unidades polipeptídicas constituídas por sequências de 440 aminoácidos..
Cada imunoglobulina possui 2 cadeias pesadas e cada uma delas possui, por sua vez, uma região variável e uma região constante. A região constante tem 330 aminoácidos e os 110 aminoácidos variáveis sequenciados.
A estrutura da cadeia pesada é diferente para cada imunoglobulina. Há um total de 5 tipos de cadeia pesada que determinam os tipos de imunoglobulina.
Os tipos de cadeia pesada são identificados pelas letras gregas γ, μ, α, ε, δ para imunoglobulinas IgG, IgM, IgA, IgE e IgD, respectivamente..
A região constante das cadeias pesadas ε e μ são formadas por quatro domínios, enquanto aqueles correspondentes a α, γ, δ têm três. Então, cada região constante será diferente para cada tipo de imunoglobulina, mas comum às imunoglobulinas do mesmo tipo..
A região variável da cadeia pesada é composta por um único domínio de imunoglobulina. Esta região possui uma sequência de 110 aminoácidos e será diferente dependendo da especificidade do anticorpo para um antígeno..
Na estrutura das cadeias pesadas pode-se observar uma angulação ou dobra - chamada de dobradiça - que representa a área flexível da corrente.
Cadeias leves
As cadeias leves de imunoglobulina são polipeptídeos constituídos por cerca de 220 aminoácidos. Existem dois tipos de cadeia leve em humanos: kappa (κ) e lambda (λ), este último com quatro subtipos. Os domínios constante e variável têm sequências de 110 aminoácidos cada..
Um anticorpo pode ter duas cadeias leves κ (κκ) ou um par de cadeias λ (λλ), mas não é possível que ele possua uma de cada tipo ao mesmo tempo.
Segmentos Fc e Fab
Uma vez que cada imunoglobulina tem o formato de um "Y", ela pode ser dividida em dois segmentos. O segmento "inferior", a base, é chamado de fração cristalizável ou Fc; enquanto os braços do "Y" formam o Fab, ou fração que se liga ao antígeno. Cada uma dessas seções estruturais da imunoglobulina desempenha uma função diferente..
Segmento Fc
O segmento Fc tem dois ou três domínios constantes de cadeias pesadas de imunoglobulina.
O Fc pode se ligar a proteínas ou a um receptor específico em basófilos, eosinófilos ou mastócitos, induzindo assim a resposta imune específica que eliminará o antígeno. Fc corresponde ao terminal carboxila da imunoglobulina.
Segmento fabuloso
A fração Fab ou segmento de um anticorpo contém os domínios variáveis em suas extremidades, além dos domínios constantes das cadeias pesadas e leves.
O domínio constante da cadeia pesada é continuado com os domínios do segmento Fc formando a dobradiça. Corresponde à extremidade amino-terminal da imunoglobulina.
A importância do segmento Fab é que ele permite a ligação com antígenos, substâncias estranhas e potencialmente nocivas.
Os domínios variáveis de cada imunoglobulina garantem sua especificidade para um determinado antígeno; esta característica permite inclusive seu uso no diagnóstico de doenças inflamatórias e infecciosas..
Tipos

As imunoglobulinas conhecidas até agora possuem uma cadeia pesada específica que é constante para cada uma delas e difere das demais..
Existem cinco variedades de cadeias pesadas que determinam cinco tipos de imunoglobulinas, cujas funções são diferentes.
Imunoglobulina G (IgG)
A imunoglobulina G é a variedade mais numerosa. Possui uma cadeia pesada gama e ocorre na forma unimolecular ou monomérica.
IgG é o mais abundante no soro sanguíneo e no espaço do tecido. Mudanças mínimas na sequência de aminoácidos de sua cadeia pesada determinam sua divisão em subtipos: 1, 2, 3 e 4.
A imunoglobulina G possui sequência de 330 aminoácidos em seu segmento Fc e peso molecular de 150.000, dos quais 105.000 correspondem à sua cadeia pesada.
Imunoglobulina M (IgM)
A imunoglobulina M é um pentâmero cuja cadeia pesada é μ. Seu peso molecular é alto, aproximadamente 900.000.
A sequência de aminoácidos de sua cadeia pesada é 440 em sua fração Fc. É encontrada predominantemente no soro sanguíneo, representando 10 a 12% das imunoglobulinas. IgM tem apenas um subtipo.
Imunoglobulina A (IgA)
Corresponde ao tipo de cadeia pesada α e representa 15% das imunoglobulinas totais. A IgA é encontrada tanto no sangue quanto nas secreções, mesmo no leite materno, apresentando-se na forma de um monômero ou dímero. O peso molecular dessa imunoglobulina é de 320.000 e possui dois subtipos: IgA1 e IgA2..
Imunoglobulina E (IgE)
A imunoglobulina E é composta pela cadeia pesada do tipo ε e é muito escassa no soro, em torno de 0,002%.
A IgE tem peso molecular de 200.000 e está presente como monômero principalmente no soro, muco nasal e saliva. Também é comum encontrar essa imunoglobulina dentro de basófilos e mastócitos..
Imunoglobulina D (IgD)
A variedade de cadeia pesada δ corresponde à imunoglobulina D, que representa 0,2% das imunoglobulinas totais. IgD tem um peso molecular de 180.000 e é estruturado como um monômero.
Está relacionado aos linfócitos B, aderidos à sua superfície. No entanto, o papel do IgD não é claro.
Mudança de tipo
As imunoglobulinas podem sofrer uma mudança estrutural de tipo, devido à necessidade de se defender contra um antígeno.
Essa mudança se deve ao papel dos linfócitos B na produção de anticorpos por meio da propriedade de imunidade adaptativa. A mudança estrutural está na região constante da cadeia pesada, sem alterar a região variável.
Uma mudança de tipo ou classe pode fazer com que um IgM mude para IgG ou IgE, e isso ocorre como uma resposta induzida por interferon gama ou interleucinas IL-4 e IL-5.
Características
O papel que as imunoglobulinas desempenham no sistema imunológico é de vital importância para a defesa do organismo.
As imunoglobulinas fazem parte do sistema imunológico humoral; ou seja, são substâncias secretadas pelas células para proteção contra patógenos ou agentes prejudiciais.
Eles fornecem um meio de defesa eficaz, eficaz, específico e sistematizado, sendo de grande valor como parte do sistema imunológico. Eles têm funções gerais e específicas dentro da imunidade:
Funções gerais
Anticorpos ou imunoglobulinas cumprem funções independentes e ativam respostas efetoras e secretoras mediadas por células.
Ligação antígeno-anticorpo
As imunoglobulinas têm a função de se ligar a agentes antigênicos específica e seletivamente.
A formação do complexo antígeno-anticorpo é a principal função de uma imunoglobulina e, portanto, é a resposta imune que pode interromper a ação do antígeno. Cada anticorpo pode se ligar a dois ou mais antígenos ao mesmo tempo.
Funções efetoras
Na maioria das vezes, o complexo antígeno-anticorpo serve como iniciador para ativar respostas celulares específicas ou para iniciar uma sequência de eventos que determinam a eliminação do antígeno. As duas respostas efetoras mais comuns são a ligação celular e a ativação do complemento..
A ligação celular depende da presença de receptores específicos para o segmento Fc da imunoglobulina, uma vez que se ligou ao antígeno.
Células como mastócitos, eosinófilos, basófilos, linfócitos e fagócitos possuem esses receptores e fornecem os mecanismos para a eliminação do antígeno..
A ativação da cascata do complemento é um mecanismo complexo que envolve o início de uma sequência, portanto, o resultado final é a secreção de substâncias tóxicas que eliminam os antígenos..
Funções específicas
Primeiro, cada tipo de imunoglobulina desenvolve uma função de defesa específica:
Imunoglobulina G
- A imunoglobulina G fornece a maioria das defesas contra agentes antigênicos, incluindo bactérias e vírus.
- IgG ativa mecanismos como complemento e fagocitose.
- A constituição de IgG específica do antígeno é durável.
- O único anticorpo que a mãe pode transferir para seus filhos durante a gravidez é o IgG.
Imunoglobulina M
- IgM é o anticorpo de resposta rápida a agentes nocivos e infecciosos, pois tem ação imediata até ser substituído por IgG.
- Este anticorpo ativa respostas celulares incorporadas na membrana dos linfócitos e respostas humorais, como complemento..
- É a primeira imunoglobulina sintetizada por humanos.
Imunoglobulina A
- Atua como barreira de defesa contra patógenos, por estar localizado nas superfícies das membranas mucosas..
- Está presente na mucosa respiratória, sistema digestivo, trato urinário e também em secreções como saliva, muco nasal e lágrimas..
- Embora sua ativação do complemento seja baixa, pode ser associada a lisozimas para matar bactérias.
- A presença de imunoglobulina D no leite materno e no colostro permite que um recém-nascido a adquira durante a amamentação.
Imunoglobulina E
- A imunoglobulina E fornece um forte mecanismo de defesa contra antígenos produtores de alergia.
- A interação entre IgE e um alérgeno causará substâncias inflamatórias responsáveis pelos sintomas de alergias, como espirros, tosse, urticária, aumento de lágrimas e muco nasal..
- A IgE também pode se prender à superfície dos parasitas por meio de seu segmento Fc, produzindo uma reação que causa sua morte..
Imunoglobulina D
- A estrutura monomérica do IgD está ligada aos linfócitos B que não interagiram com os antígenos, portanto, eles desempenham o papel de receptores.
- O papel do IgD não é claro.
Referências
- (s.f.) Definição médica de imunoglobulina. Recuperado de medicinenet.com
- Wikipedia (s.f.). Anticorpo. Recuperado de en.wikipedia.org
- Grattendick, K., Pross, S. (2007). Imunoglobulinas. Recuperado de sciencedirect.com
- Iáñez, E. (s.f.). Imunoglobulinas e outras moléculas de células B. Curso de imunologia geral. Recuperado de ugr.es
- (s.f.) Introdução às imunoglobulinas. Recuperado de thermofisher.com
- Buddiga, P. (2013). Anatomia do sistema imunológico. Recuperado de emedicine.medscape.com
- Biochemistryquestions (2009). Imunoglobulinas: estrutura e funções. Recuperado de biochemistryquestions.wordpress.com
- (s.f.) Imunoglobulinas - estrutura e função. Recuperado de microbiologybook.org



Ainda sem comentários