
Fórmula, propriedades e usos do íon amônio (NH4 +)

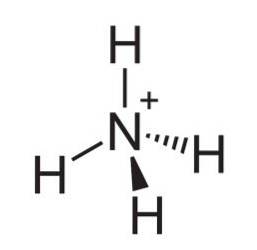
O íon amônio é um cátion poliatômico com carga positiva, cuja fórmula química é NH4+. A molécula não é plana, mas tem a forma de um tetraedro. Os quatro átomos de hidrogênio constituem os quatro cantos.
O nitrogênio da amônia tem um par não compartilhado de elétrons capaz de aceitar um próton (base de Lewis), portanto, o íon amônio é formado pela protonação da amônia de acordo com a reação: NH3 + H+ → NH4+
O nome amônio também é dado a aminas substituídas ou cátions de amônio substituídos. Por exemplo, cloreto de metilamônio é um sal iônico de fórmula CH3NH4Cl onde o íon cloreto está ligado a uma metilamina.
O íon amônio tem propriedades muito semelhantes às dos metais alcalinos mais pesados e costuma ser considerado um parente próximo. Espera-se que o amônio se comporte como um metal em pressões muito altas, como no interior de planetas gigantes gasosos como Urano e Netuno..
O íon amônio desempenha um papel importante na síntese de proteínas no corpo humano. Em suma, todos os seres vivos precisam de proteínas, que são compostas por cerca de 20 aminoácidos diferentes. Enquanto as plantas e microorganismos podem sintetizar a maioria dos aminoácidos do nitrogênio na atmosfera, os animais não podem..
Para os humanos, alguns aminoácidos não podem ser sintetizados e devem ser consumidos como aminoácidos essenciais.
Outros aminoácidos, entretanto, podem ser sintetizados por microrganismos no trato gastrointestinal com a ajuda de íons amônia. Assim, esta molécula é uma figura chave no ciclo do nitrogênio e na síntese de proteínas..
Índice do artigo
- 1 propriedades
- 1.1 Solubilidade e peso molecular
- 1.2 Propriedades ácido-base
- 1.3 Sais de amônio
- 2 usos
- 3 referências
Propriedades
Solubilidade e peso molecular
O íon amônio tem um peso molecular de 18,039 g / mol e uma solubilidade de 10,2 mg / ml de água (National Center for Biotechnology Information, 2017). A dissolução da amônia na água forma o íon amônio de acordo com a reação:
NH3 + HdoisO → NH4+ + Oh-
Isso aumenta a concentração de hidroxila no meio, aumentando o pH da solução (Royal Society of Chemistry, 2015).
Propriedades de base ácida
O íon amônio tem um pKb de 9,25. Isso significa que em pH superior a este valor terá um comportamento ácido e em pH inferior terá um comportamento básico..
Por exemplo, ao dissolver amônia em ácido acético (pKa = 4,76), o par de elétrons livres de nitrogênio retira um próton do meio, aumentando a concentração de íons hidróxido de acordo com a equação:
NH3 + CH3COOH ⇌ NH4+ + CH3COO-
No entanto, na presença de uma base forte, como hidróxido de sódio (pKa = 14,93), o íon amônio produz um próton para o meio de acordo com a reação:
NH4+ + NaOH ⇌ NH3 + N / D+ + HdoisOU
Em conclusão, em pH inferior a 9,25, o nitrogênio será protonado, enquanto em pH superior a esse valor será desprotonado. Isso é de extrema importância para a compreensão das curvas de titulação e do comportamento de substâncias como os aminoácidos..
Sais de amônio
Uma das propriedades mais características da amônia é seu poder de se combinar diretamente com ácidos para formar sais, dependendo da reação:
NH3 + HX → NH4X
Assim, com o ácido clorídrico forma cloreto de amônio (NH4Cl); Com ácido nítrico, nitrato de amônio (NH4NÃO3), com ácido carbônico formará carbonato de amônio ((NH4)doisCO3) etc.
Foi demonstrado que a amônia perfeitamente seca não se combinará com o ácido clorídrico perfeitamente seco, sendo a umidade necessária para causar a reação (VIAS Encyclopedia, 2004).
A maioria dos sais de amônio simples são muito solúveis em água. Uma exceção é o hexacloroplatinato de amônio, cuja formação é usada como teste de amônio. Os sais de nitrato de amônio e principalmente perclorato são altamente explosivos, nestes casos o amônio é o agente redutor.
Em um processo incomum, os íons de amônio formam um amálgama. Essas espécies são preparadas por eletrólise de uma solução de amônio usando um cátodo de mercúrio. Este amálgama eventualmente se decompõe para liberar amônia e hidrogênio (Johnston, 2014).
Um dos sais de amônio mais comuns é o hidróxido de amônio, que é simplesmente amônia dissolvida em água. Este composto é muito comum e é encontrado naturalmente no meio ambiente (no ar, na água e no solo) e em todas as plantas e animais, incluindo humanos..
Formulários
O amônio é uma importante fonte de nitrogênio para muitas espécies de plantas, especialmente aquelas que crescem em solos hipóxicos. No entanto, também é tóxico para a maioria das espécies de cultivo e raramente é aplicado como única fonte de nitrogênio (Database, Human Metabolome, 2017).
O nitrogênio (N), ligado às proteínas na biomassa morta, é consumido por microrganismos e convertido em íons de amônio (NH4 +) que podem ser absorvidos diretamente pelas raízes das plantas (por exemplo, arroz).
Os íons amônio são geralmente convertidos em íons nitrito (NO2-) pelas bactérias nitrosomonas, seguidos por uma segunda conversão em nitrato (NO3-) pelas bactérias Nitrobacter..
As três principais fontes de nitrogênio usadas na agricultura são uréia, amônio e nitrato. A oxidação biológica da amônia em nitrato é conhecida como nitrificação. Este processo envolve várias etapas e é mediado por bactérias aeróbias autotróficas obrigatórias..
Em solos inundados, a oxidação de NH4 + é restrita. A ureia é decomposta pela enzima urease ou quimicamente hidrolisada em amônia e CO2.
Na etapa de amonificação, a amônia é convertida pela amonificação das bactérias no íon amônio (NH4 +). Na próxima etapa, o amônio é convertido por bactérias nitrificantes em nitrato (nitrificação).
Esta forma altamente móvel de nitrogênio é mais comumente absorvida pelas raízes das plantas, bem como por microorganismos no solo..
Para fechar o ciclo do nitrogênio, o gás nitrogênio na atmosfera é convertido em nitrogênio da biomassa pelas bactérias Rhizobium que vivem nos tecidos das raízes de leguminosas (por exemplo, alfafa, ervilhas e feijões) e leguminosas (como amieiro). E por cianobactérias e Azotobacter (Sposito, 2011).
Por meio do amônio (NH4 +), as plantas aquáticas podem absorver e incorporar nitrogênio em proteínas, aminoácidos e outras moléculas. Altas concentrações de amônia podem aumentar o crescimento de algas e plantas aquáticas.
O hidróxido de amônio e outros sais de amônio são amplamente usados no processamento de alimentos. Os regulamentos da Food and Drug Administration (FDA) declaram que o hidróxido de amônio é seguro ("geralmente reconhecido como seguro" ou GRAS) como um agente de levedura, agente de controle de pH e agente de acabamento..
A lista de alimentos em que o hidróxido de amônio é usado como aditivo alimentar direto é extensa e inclui produtos de panificação, queijos, chocolates, outros produtos de confeitaria (por exemplo, doces) e pudins. O hidróxido de amônio também é usado como agente antimicrobiano em produtos cárneos.
A amônia em outras formas (por exemplo, sulfato de amônio, alginato de amônio) é usada em temperos, isolados de proteína de soja, lanches, geleias e geléias e bebidas não alcoólicas (associação de nitrato de potássio PNA, 2016).
A medição de amônio é usada no teste RAMBO, particularmente útil no diagnóstico da causa da acidose (ID do teste: RAMBO Ammonium, Random, Urine, S.F.). O rim regula a excreção de ácido e o equilíbrio ácido-base sistêmico.
Alterar a quantidade de amônia na urina é uma forma importante de os rins fazerem isso. Medir o nível de amônia na urina pode fornecer informações sobre a causa de um distúrbio do equilíbrio ácido-básico nos pacientes..
O nível de amônia na urina também pode fornecer muitas informações sobre a produção diária de ácido em um determinado paciente. Como a maior parte da carga de ácido de um indivíduo vem da proteína ingerida, a quantidade de amônia na urina é um bom indicador da ingestão de proteína na dieta.
As medições de amônia na urina podem ser particularmente úteis para o diagnóstico e tratamento de pacientes com cálculos renais:
- Altos níveis de amônia na urina e um baixo pH urinário sugerem perdas gastrointestinais contínuas. Esses pacientes apresentam risco de desenvolver cálculos de ácido úrico e oxalato de cálcio..
- Um pouco de amônia na urina e pH alto da urina sugerem acidose tubular renal. Esses pacientes estão em risco de pedras de fosfato de cálcio.
- Pacientes com pedras de oxalato de cálcio e fosfato de cálcio são freqüentemente tratados com citrato para aumentar o citrato na urina (um inibidor natural do crescimento de cristais de oxalato de cálcio e fosfato de cálcio)..
No entanto, como o citrato é metabolizado em bicarbonato (uma base), essa droga também pode aumentar o pH da urina. Se o pH da urina for muito alto com o tratamento com citrato, o risco de cálculos de fosfato de cálcio pode aumentar inadvertidamente..
Monitorar a urina em busca de amônia é uma maneira de ajustar a dose de citrato e evitar esse problema. Uma boa dose inicial de citrato é cerca de metade da excreção de amônio na urina (em mEq de cada).
O efeito desta dose nos valores de amônio, citrato e pH urinário pode ser monitorado, e a dose de citrato ajustada com base na resposta. Uma queda na amônia na urina deve indicar se o citrato atual é suficiente para neutralizar parcialmente (mas não completamente) a carga diária de ácido daquele determinado paciente..
Referências
- Database, Human Metabolome. (2017, 2 de março). Mostrando metabocard para amônio. Recuperado de: hmdb.ca.
- Johnston, F. J. (2014). Sal de amônio. recuperado de accessscience: accessscience.com.
- Centro Nacional de Informações sobre Biotecnologia. (2017, 25 de fevereiro). PubChem Compound Database; CID = 16741146. Obtido em PubChem.
- Associação de nitrato de potássio com PNA. (2016). Nitrato (NO3-) versus amônio (NH4 +). recuperado de kno3.org.
- Royal Society of Chemistry. (2015). Íon amônio. Recuperado de chemspider: chemspider.com.
- Sposito, G. (2011, 2 de setembro). Solo. Recuperado da enciclopédia britânica: britannica.com.
- ID do teste: RAMBO Ammonium, Random, Urine. (S.F.). Recuperado de encyclopediamayomedicallaboratorie.com.
- VIAS Encyclopedia. (2004, 22 de dezembro). Sais de amônio. Recuperado da enciclopédia vias.org.



Ainda sem comentários