
Isomeria
O que é isomeria?
Isomeria é um fenômeno químico caracterizado por moléculas com o mesmo número de átomos terem diferentes propriedades químicas ou físicas. Assim, ocorre em isômeros, que por sua vez são moléculas cujas fórmulas químicas são as mesmas, mas suas estruturas ou arranjos espaciais diferem substancialmente entre si..
Temos isomerismo constitucional ou estrutural e isomerismo espacial, que concentra muita atenção na estereoquímica. O fluxograma na imagem abaixo mostra que os isômeros são divididos principalmente nos dois tipos de isomerismo mencionados: constitucional e estereoisômeros..
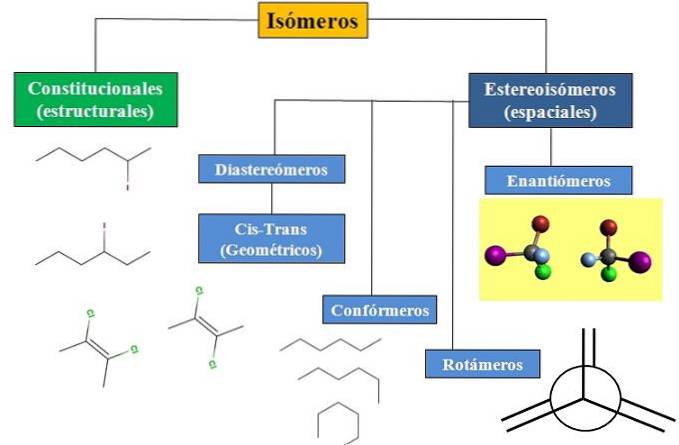
Todos os isômeros, para um determinado composto, têm a mesma fórmula química. Mas as estruturas que esses átomos podem construir e suas proporções são únicas para cada molécula ou isômero. Além disso, embora a estrutura em si seja a mesma, os átomos ou grupos podem ocupar diferentes posições espaciais..
O fluxograma mostra alguns exemplos de isômeros que serão discutidos nas próximas seções..
Tipos de isômeros
Constitucional
Isômeros constitucionais ou estruturais são aqueles que diferem na ordenação da estrutura molecular. Ou seja, seus átomos não estão ligados da mesma maneira, então a estrutura ou grupos funcionais em questão podem se tornar muito diferentes..
Por exemplo, para a mesma fórmula química C7H10Ou pode haver várias moléculas que atendam a esse número de átomos; todos eles terão um único átomo de oxigênio, mas o arranjo estrutural dos outros átomos será único para cada isômero.
E, portanto, as propriedades químicas e físicas de todos os isômeros constitucionais para a fórmula C7H10Ou eles também serão muito diferentes uns dos outros.
Por outro lado, os isômeros constitucionais podem ser muito simples, variando apenas na posição relativa de um único átomo ou grupo. Na próxima seção, você verá um exemplo disso e o dito acima.
Estereoisômeros
Estereoisômeros são aqueles que têm a mesma ordem estrutural, mas diferem nas posições e orientações espaciais de seus átomos ou grupos..
Para que sua existência seja possível, as moléculas devem conter centros estereogênicos, sendo os mais famosos na química orgânica os átomos de carbono assimétricos ou quirais; isto é, com quatro substituintes diferentes.
Além dos carbonos assimétricos, a molécula considerada deve carecer de elementos de simetria. Caso contrário, é impossível que a ordenação espacial se torne estereoisomeria..
Enantiômeros
Enantiômeros são estereoisômeros que consistem em imagens de espelho não sobrepostas. Por exemplo, as mãos direita e esquerda não se sobrepõem, assim como os sapatos ou as luvas. A próxima seção abordará o exemplo clássico de enantiomerismo: bromocloro dometano: CBrClI.
Diastereômeros
Os diastereômeros, por outro lado, também são estereoisômeros, mas não são imagens no espelho. Ou seja, aqueles colocados um na frente do outro não são o reflexo de si mesmos. Dos diastereômeros mais conhecidos temos o isomerismo cis-trans, também chamado de isomeria geométrica, principalmente quando aplicado a alquenos..
Conformadores
Conformadores, embora dentro do espectro de estereoisomeria, não são realmente isômeros. São configurações espaciais que uma molécula, em determinado momento ou estado de energia, adquire por meio da rotação de várias de suas ligações. Veremos na próxima seção o exemplo dos conformadores do n-hexano.
Rotamers
Finalmente, temos os rotâmeros, que se assemelham aos conformadores no sentido de que dependem da rotação das ligações covalentes..
No entanto, uma ligação simples entre dois átomos de carbono é tomada como referência, e as posições relativas, eclipsadas ou alternadas, dos substituintes para ambos os carbonos são comparadas. Mais tarde veremos o exemplo de rotâmeros de propileno.
Exemplos de isômeros
Hexano iodo
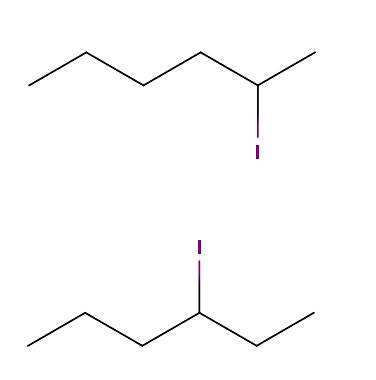
Acima temos duas moléculas cujas fórmulas químicas são C6H13I. No primeiro, temos 2-iodohexano, enquanto no segundo, 3-iodohexano. São isômeros constitucionais do tipo posicional, já que o esqueleto é o mesmo, com a diferença de que a posição do átomo de iodo varia de um carbono para outro..
C3H8OU
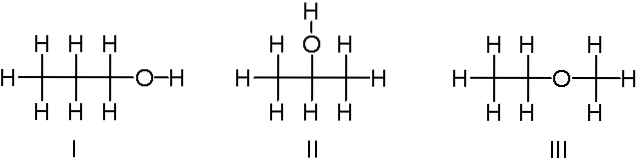
Acima, temos outro exemplo de isômeros constitucionais para a fórmula química C3H8O. As moléculas I e II são 1-propanol e 2-propanol, respectivamente. Ambos são álcoois. Em vez disso, a molécula III é sobre etil-metil-éter.
Portanto, falamos de outro grupo funcional. Observe que as três moléculas têm o mesmo número de átomos, mas suas estruturas são diferentes..
2,3-dicloro-2-buteno
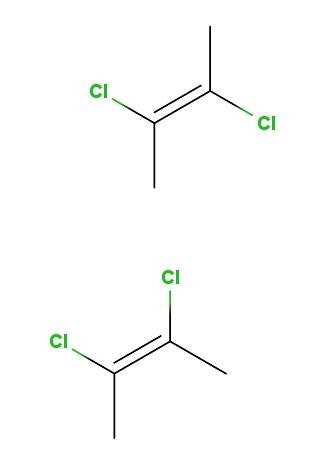
Acima temos o isômero trans-2,3-dicloro-2-buteno, e abaixo temos o isômero cis-2,3-dicloro-2-buteno. No primeiro, os átomos de cloro estão em posições opostas em relação à ligação dupla, enquanto no segundo eles estão do mesmo lado da ligação dupla..
A espinha dorsal de ambas as moléculas é a mesma, mas elas diferem nas posições espaciais dos átomos de cloro; portanto, eles são estereoisômeros e, uma vez que não são imagens de espelho, eles se tornam diastereômeros.
3-flúor-2-metilciclohexano
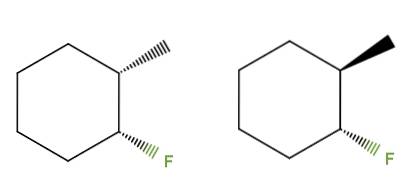
Desta vez, em vez de uma ligação dupla, temos um anel de ciclohexano para o composto 3-fluoro-2-metilciclohexano. No isômero esquerdo, os grupos CH3 e F estão abaixo do plano do anel; enquanto no da direita, o CH3 está para cima e o F está para baixo.
Portanto, o da esquerda corresponderia ao isômero cis, e o da direita seria o isômero trans. Eles são, portanto, diastereômeros, porque, novamente, eles não são imagens de espelho.
Conformadores de n-hexano
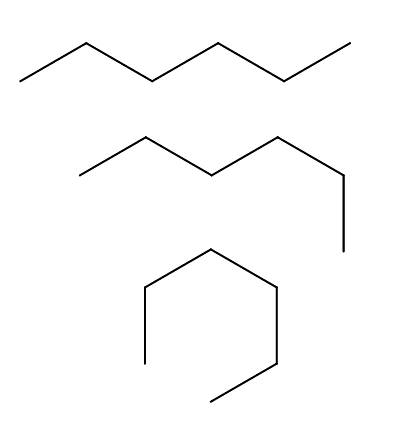
Temos mais de três conformadores do n-hexano, que resulta das rotações e "curvas" da cadeia de carbono em diferentes orientações. Todos eles correspondem à mesma molécula de n-hexano com diferentes níveis de dobramento, que vão depender do ambiente e da energia interna de cada molécula.
3-bromo-2-pentanol
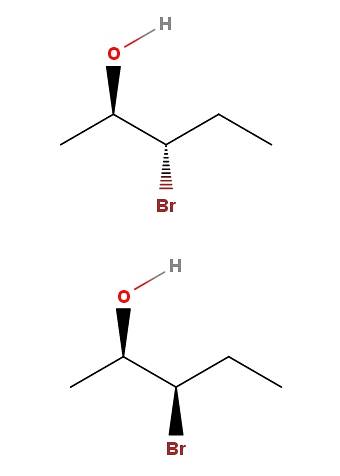
Em 3-bromo-2-pentanol, temos outro exemplo de um par de diastereômeros. Observe que, mais uma vez, no isômero acima temos OH e Br apontando nas direções opostas do plano do esqueleto; enquanto no isômero inferior, ambos os grupos apontam para a direção do leitor.
1-bromo-3-cloro-5-etilciclohexano
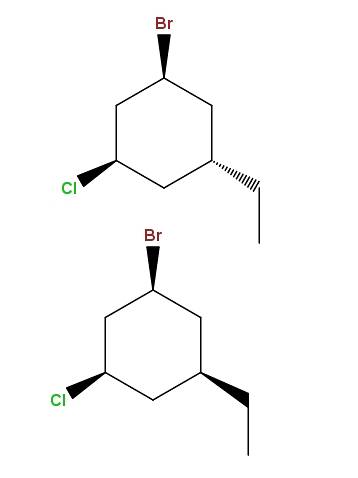
E mais uma vez, temos outro par de diastereômeros, com a diferença de que agora a diferença está na posição espacial de um único grupo: o etil, -CHdoisCH3.
Este tipo de isômeros tem um nome muito específico: epímeros, que são diastereômeros cuja variação é observada apenas na configuração espacial de um único carbono assimétrico; neste caso, aquele ligado ao -CHdoisCH3.
Bromoclorooyodometano
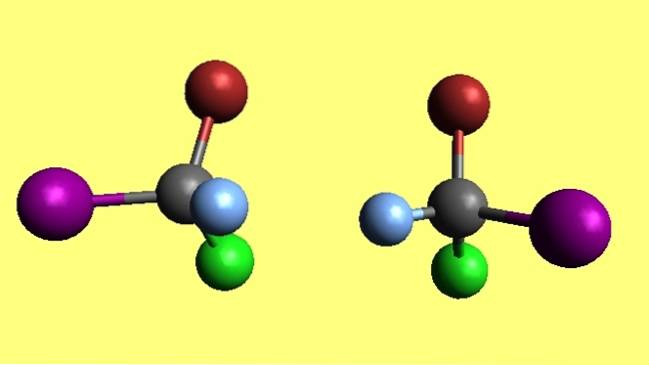
Observe que as duas moléculas de bromocloroiodometano, CBrClI, são enantiômeros porque uma é o reflexo não sobreposto da outra. Não importa o quanto você tente, seus quatro átomos nunca irão coincidir. Diz-se que possuem configurações espaciais opostas.
2-bromo-4-etilciclohexano
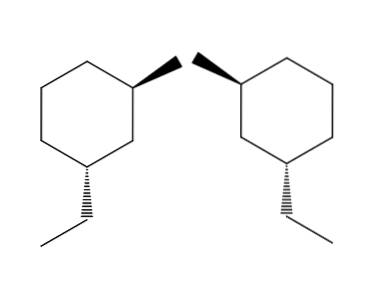
No exemplo do par de moléculas 2-bromo-4-etilciclohexano, o enantiomerismo é ainda mais evidente. Se tentarmos inverter a molécula à direita, veremos que o grupo -CHdoisCH3 não estará localizado abaixo do anel, mas acima.
Da mesma forma, o CH3 Não apontará para cima do anel, mas abaixo dele. As configurações espaciais são invertidas, elas são opostas. Esta é outra das características mais importantes da enatiomerismo..
Rotâmeros de propileno
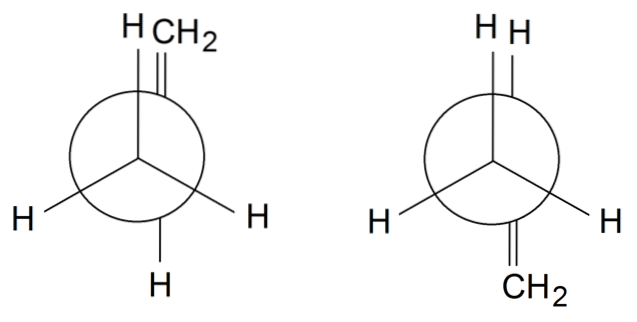
Em rotâmeros de propileno, para terminar, giramos a ligação simples entre C1 e Cdois: H3C-CH = CHdois. O grupo = CHdois está em uma posição eclipsada com um dos Hs do grupo CH3 frente no rotâmetro à esquerda. Enquanto isso, o = CHdois e H estão em posições alternadas no rotamer direito.
Dependendo do eclipse ou não dos grupos, teremos impedimento estérico, que desestabilizará o rotamer. Portanto, o rotamer à direita é mais estável do que o da esquerda..
Referências
- Graham Solomons T.W., Craig B. Fryhle. (2011). Química orgânica. (10º edição.). Wiley plus.
- Carey F. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Dr. S. Gevorg. (2020). Enantiômeros, diastereômeros, isômeros idênticos ou constitucionais. Etapas de química. Recuperado de: chemistrysteps.com
- Wikipedia. (2020). Isômero. Recuperado de: en.wikipedia.org
- Allison Soult. (13 de agosto de 2020). Isômeros. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- James Ashenhurst. (2020). Stereochemistry and Chirality. Recuperado de: masterorganicchemistry.com



Ainda sem comentários