
Funções de LDH, determinação, reação, valores normais
O lactato desidrogenase, Ácido láctico desidrogenase, lactato desidrogenase dependente de NAD ou simplesmente LDH, é uma enzima pertencente ao grupo das oxidorredutases que se encontra em praticamente todos os tecidos animais e vegetais e em muitos microrganismos como bactérias, leveduras e arqueas.
Enzimas deste tipo são denotadas pelo número EC 1.1.1.27 do Comitê de Nomenclatura de Enzimas e são responsáveis pela reação que converte lactato em piruvato (por oxidação) e vice-versa (por redução), oxidando ou reduzindo dinucleotídeos de nicotinamida adenina (NAD + e NADH) no processo conhecido como fermentação láctica.
Ao contrário da fermentação alcoólica, que ocorre apenas em alguns microrganismos como a levedura e que usa piruvato glicolítico para a produção de etanol, a fermentação láctica ocorre em muitos organismos e tecidos corporais de diferentes seres vivos..
Essa importante enzima para o metabolismo celular foi cristalizada do músculo esquelético de rato na década de 1940 e, até o momento, os mais bem caracterizados são o músculo esquelético e o tecido cardíaco de mamíferos..
Em animais "superiores", a enzima usa o isômero L do lactato (L-lactato) para a produção de piruvato, mas alguns animais "inferiores" e bactérias produzem D-lactato a partir do piruvato obtido por glicólise..
A lactato desidrogenase é geralmente expressa principalmente em tecidos ou células em condições anaeróbias (com baixo suprimento de sangue) que, em humanos, por exemplo, podem caracterizar condições patológicas como câncer, fígado ou coração.
No entanto, a conversão de piruvato em lactato é típica dos músculos durante o exercício e da córnea do olho, que é pouco oxigenada.
Índice do artigo
- 1 funções
- 2 Características e estrutura
- 3 Determinação
- 3.1 Por espectrofotometria
- 3.2 Por imunohistoquímica
- 3.3 Por que determinar a lactato desidrogenase?
- 4 Reação
- 5 valores normais
- 6 O que significa ter um HDL alto?
- 7 referências
Características
A lactato desidrogenase tem várias funções em várias vias metabólicas. É o centro do delicado equilíbrio entre as vias catabólicas e anabólicas dos carboidratos.
Durante a glicólise aeróbica, piruvato (o último produto na via per se) pode ser usado como um substrato para o complexo da enzima piruvato desidrogenase, pelo qual é descarboxilado, liberando moléculas de acetil-CoA que são usadas a jusante, metabolicamente falando, no ciclo de Krebs.
Na glicólise anaeróbica, por outro lado, a última etapa da glicólise produz piruvato, mas este é usado pela lactato desidrogenase para produzir lactato e NAD.+, que restaura o NAD+ que foi usado durante a reação catalisada pela gliceraldeído 3-fosfato desidrogenase.
Como durante a anaerobiose a principal fonte de produção de energia na forma de ATP é a glicólise, a lactato desidrogenase desempenha papel fundamental na reoxidação do NADH produzido nas etapas anteriores da via glicolítica, essencial para o funcionamento de outras enzimas relacionadas..
A lactato desidrogenase também está envolvida na glicogênese que ocorre nos tecidos que convertem lactato em glicogênio e, em alguns tecidos aeróbios como o coração, o lactato é um combustível que é reoxidado para produzir energia e poder redutor na forma de ATP e NAD+, respectivamente.
Características e estrutura
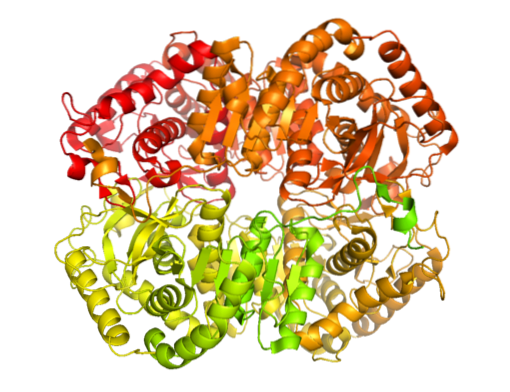
Existem várias formas moleculares de desidrogenase láctica na natureza. Apenas em animais foi determinado que existem cinco atividades de lactato desidrogenase, todas tetraméricas e essencialmente compostas por dois tipos de cadeias polipeptídicas conhecidas como subunidades H e M (podem ser homo ou heterotetraméricas).
A forma H é normalmente encontrada no tecido cardíaco, enquanto a forma M foi detectada no músculo esquelético. Ambas as cadeias diferem entre si em termos de abundância, composição de aminoácidos, propriedades cinéticas e propriedades estruturais..
As formas H e M são o produto translacional de diferentes genes, possivelmente localizados em diferentes cromossomos, e que também estão sob o controle ou regulação de diferentes genes. A forma H é predominante em tecidos com metabolismo aeróbio e a forma M em tecidos anaeróbicos..
Outro tipo de nomenclatura usa as letras A, B e C para os diferentes tipos de enzimas em mamíferos e aves. Assim, a lactato desidrogenase muscular é conhecida como A4, o cardíaco como B4 e um terceiro é chamado C4, que é específico para os testículos.
A expressão dessas isoenzimas é regulada tanto dependente do desenvolvimento quanto dependente do tecido..
A enzima foi isolada de diferentes fontes animais e foi determinado que sua estrutura tetramérica tem um peso molecular médio de cerca de 140 kDa e que o local de ligação para NADH ou em NAD+ consiste em uma folha dobrada β composta por seis cadeias e 4 hélices alfa.
Determinação
Por espectrofotometria
A atividade da lactato desidrogenase de origem animal é determinada espectrofotometricamente em vitro por medidas de mudança de cor devido ao processo redox que ocorre durante a reação de conversão de piruvato em lactato.
As medições são feitas a 340 nm com um espectrofotômetro e a taxa de diminuição da densidade óptica devido à oxidação ou "desaparecimento" do NADH, que é convertido em NAD, é determinada.+.
Ou seja, a reação determinada é a seguinte:
Piruvato + NADH + H+ → Lactato + NAD+
A medição enzimática deve ser realizada em condições ótimas de pH e concentração de substratos para a enzima, de forma que não haja risco de subestimar a quantidade presente nas amostras por déficit de substratos ou condições extremas de acidez ou basicidade.
Por imunohistoquímica
Outro método, talvez um pouco mais moderno, para determinar a presença da lactato desidrogenase diz respeito ao uso de ferramentas imunológicas, ou seja, ao uso de anticorpos..
Esses métodos tiram vantagem da afinidade entre a ligação de um antígeno com um anticorpo especificamente gerado contra ele e são muito úteis para a determinação rápida da presença ou ausência de enzimas como a LDH em um determinado tecido..
Dependendo da finalidade, os anticorpos utilizados devem ser específicos para a detecção de qualquer uma das isoenzimas ou de qualquer proteína com atividade de lactato desidrogenase..
Por que determinar a lactato desidrogenase?
A determinação desta enzima é realizada para diversos fins, mas principalmente para o diagnóstico clínico de algumas condições, incluindo enfarte do miocárdio e cancro..
No nível celular, a liberação da lactato desidrogenase tem sido considerada como um dos parâmetros para determinar a ocorrência de processos necróticos ou apoptóticos, uma vez que a membrana plasmática torna-se permeável..
Os produtos da reação que catalisa também podem ser determinados em um tecido, a fim de determinar se um metabolismo anaeróbico predomina por algum motivo particular..
Reação
Como mencionado inicialmente, a enzima lactato desidrogenase, cujo nome sistemático é (S) -lactato: NAD+ desidrogenase, catalisa a conversão de lactato em piruvato na forma NAD+ dependente, ou vice-versa, que ocorre graças à transferência de um íon hidreto (H-) de piruvato para lactato ou de NADH para piruvato oxidado.

O NAD+ Possui uma unidade de ADP e outro grupo de nucleotídeos derivado do ácido nicotínico, também chamado de niacina ou vitamina B3, e esta coenzima participa de múltiplas reações de grande importância biológica..
É importante notar que o equilíbrio nesta reação é desviado para o lado do lactato e foi demonstrado que a enzima também é capaz de oxidar outros ácidos (S) -2-hidroximonocarboxílicos e empregam, embora menos eficientemente, NADP+ como um substrato.
Dependendo da região corporal considerada e, ao mesmo tempo, de suas características metabólicas em relação à presença ou ausência de oxigênio, os tecidos produzem diferentes quantidades de lactato, produto da reação catalisada pela LDH..
Considerando, por exemplo, um glóbulo vermelho (eritrócito) que não possui mitocôndrias que podem metabolizar o piruvato produzido durante a glicólise em COdois e água, então pode-se dizer que essas são as principais células produtoras de lactato no corpo humano, uma vez que todo piruvato é convertido em lactato pela ação da lactato desidrogenase..
Por outro lado, se forem consideradas as células do fígado e as células do músculo esquelético, elas são responsáveis pela produção de uma quantidade mínima de lactato, uma vez que é rapidamente metabolizado..
Valores normais
A concentração de lactato desidrogenase no soro sanguíneo é o produto da expressão de várias isoenzimas no fígado, coração, músculo esquelético, eritrócitos e tumores, entre outros..
No soro sanguíneo, os intervalos normais de atividade da lactato desidrogenase estão entre 260 e 850 U / ml (unidades por mililitro), com um valor médio de 470 ± 130 U / ml. Enquanto isso, os hemolisados sanguíneos têm uma atividade de LDH que varia entre 16.000 e 67.000 U / ml, o que equivale a uma média de 34.000 ± 12.000 U / ml..
O que significa ter um HDL alto?
A quantificação da concentração da lactato desidrogenase no soro sanguíneo tem um valor importante no diagnóstico de algumas doenças cardíacas, hepáticas, sanguíneas e até mesmo cânceres..
Altos níveis de atividade de LDH foram encontrados em pacientes com enfartes do miocárdio (experimentais e clínicos), bem como em pacientes com câncer, especificamente em mulheres com câncer de endométrio, ovário, mama e útero..
Dependendo da isoenzima específica encontrada em "excesso" ou alta concentração, a quantificação das isoenzimas lactato desidrogenase é usada por muitos médicos para a determinação de danos aos tecidos (graves ou crônicos)..
Referências
- Bergmeyer, H., Bernt, E., & Hess, B. (1961). Desidrogenase Lática. Métodos de análise enzimática. Verlag Chemie, GmbH.
- Chung, F., Tsujubo, H., Bhattacharyya, U., Sharief, F., & Li, S. (1985). Organização genômica do gene humano da lactato desidrogenase-A. Biochemical Journal, 231, 537-541.
- De Becker, D. (2003). Acidose láctica. Terapia Intensiva MEd, 29, 699-702.
- Everse, J., & Kaplan, N. (1973). Lactato Desidrogenases: Estrutura e Função. Dentro Avanços em Enzimologia e Áreas Relacionadas de Biologia Molecular (pp. 61-133).
- Fox, S. I. (2006). Fisiologia humana (9ª ed.). Nova York, EUA: McGraw-Hill Press.
- Huijgen, H., Sanders, G. T. B., Koster, R. W., Vreeken, J., & Bossuyt, P. M. M. (1997). O valor clínico da lactato desidrogenase no soro: uma revisão quantitativa. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Comitê de Nomenclatura da União Internacional de Bioquímica e Biologia Molecular (NC-IUBMB). (2019). Obtido em www.qmul.ac.uk/sbcs/iubmb/enzyme/index.html
- Rawn, J. D. (1998). Bioquímica. Burlington, Massachusetts: Neil Patterson Publishers.
- Usategui-Gomez, M., Wicks, R. W., & Warshaw, M. (1979). Determinação imunoquímica da isoenzima cardíaca da lactato desidrogenase (LDH1) no soro humano. Clin Chem, 25(5), 729-734.
- Wróblewski, F., & Ladue, J. S. (1955). Atividade de degidrogenase láctica no sangue. Biologia Experimental e Medicina, 90, 210-215.


Ainda sem comentários