
Chuva ácida como se forma, composição, reações e efeitos

O Chuva ácida É a precipitação úmida ou seca de substâncias que geram um pH inferior a 5,6. Esta precipitação pode ser úmida (diluída na água da chuva) ou seca (deposição de partículas ou aerossóis).
O termo "chuva ácida" foi proposto pela primeira vez pelo pesquisador inglês Robert Angus Smith em 1850, em plena Revolução Industrial. Os ácidos mais abundantes que se formam na atmosfera são o nítrico e o sulfúrico por oxidação de poluentes naturais ou artificiais..
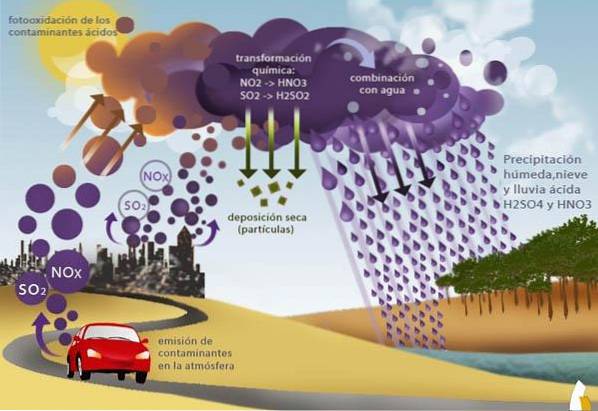
Os poluentes mais relevantes são os óxidos: NO2, NO3, SO2, cujas fontes naturais são erupções vulcânicas, incêndios florestais e degradação bacteriana. As fontes artificiais são as emissões de gases provenientes da queima de combustíveis fósseis (atividade industrial e tráfego automotivo).
A chuva ácida causa impactos negativos ao meio ambiente, como acidificação de solos e águas, afetando seres vivos, inclusive humanos. Da mesma forma, os solos e a água estão contaminados com metais pesados e a eutrofização ocorre nos corpos d'água..
No nível da vegetação, ocorrem danos diretos às folhas e o crescimento das plantas é afetado. Além disso, a acidificação do solo imobiliza nutrientes e afeta as micorrizas (fungos do solo). Da mesma forma, edifícios, máquinas, monumentos e obras de arte expostos aos elementos são gravemente oxidados ou erodidos pelo efeito de ácidos precipitados..
Para remediar o efeito da chuva ácida, algumas medidas essenciais podem ser tomadas, como proteger os monumentos e corrigir a acidificação dos solos e das águas. No entanto, a solução básica para a chuva ácida é reduzir a emissão para a atmosfera de compostos químicos precursores da formação de ácidos..
Índice do artigo
- 1 Como a chuva ácida é formada?
- 1.1 Precursores químicos
- 1.2 Processo troposférico e ácidos produzidos
- 1.3 Precipitação
- 2 Composição
- 3 Reações químicas da chuva ácida
- 3.1 Formação de ácido sulfúrico (H2SO4)
- 3.2 Formação de ácido nítrico (HNO3)
- 4 efeitos no meio ambiente
- 4.1 Acidificação do solo e seus efeitos na vegetação
- 4.2 Efeito nos aquíferos e na saúde humana
- 4.3 Deterioração de edifícios, monumentos e materiais
- 5 Flora e fauna
- 5.1 Plantas e animais em corpos lênticos de água
- 5.2 Vegetação e disponibilidade de nutrientes
- 5.3 Danos diretos a plantas e animais
- 6 soluções
- 6.1 Reduzir as emissões
- 6.2 Aplicar medidas de correção de acidez
- 6.3 Proteção de superfície
- 7 referências
Como a chuva ácida é formada?

Agentes precursores químicos
O fenômeno da chuva ácida começa com a emissão para a atmosfera de compostos químicos que são precursores da formação de ácidos. Esses compostos podem ser emitidos por fontes naturais ou artificiais.
As fontes naturais incluem erupções vulcânicas, incêndios em vegetação e emissões oceânicas. Como fontes artificiais atuam emissões industriais, emissões de veículos automotores de combustão ou queima de resíduos.
Essas fontes emitem vários compostos que podem gerar ácidos na atmosfera. No entanto, os mais importantes são óxidos de nitrogênio e óxidos de enxofre.
Os óxidos de nitrogênio são conhecidos como NOx e incluem dióxido de nitrogênio (NO2) e óxido nitroso (NO). Por sua vez, o óxido de enxofre é SO2 ou dióxido de enxofre.
Processo troposférico e ácidos produzidos
O fenômeno da chuva ácida ocorre na troposfera (zona atmosférica que vai da superfície da Terra a uma altura de 16 km).
Na troposfera, as correntes de ar podem transportar esses compostos por qualquer parte do planeta, tornando-se um problema global. Nesse processo, os óxidos de nitrogênio e de enxofre interagem com outros compostos para formar ácido nítrico e ácido sulfúrico, respectivamente..
Suporte de reação
As reações químicas podem ser realizadas em partículas sólidas em suspensão ou em gotas de água em suspensão..
O ácido nítrico é formado principalmente na fase gasosa, devido à sua baixa solubilidade em água. Já o ácido sulfúrico é mais solúvel em água, sendo o principal constituinte da chuva ácida.
Ácido nítrico
Para a formação de ácido nítrico (HNO3), os óxidos de nitrogênio reagem com a água, com radicais como OH (em menor grau com HO2 e CH3O2), ou com ozônio troposférico (O3).
Ácido sulfúrico
No caso da produção de ácido sulfúrico (H2SO4) os radicais OH, HO2, CH3O2, água e ozônio também participam. Além disso, pode ser formado pela reação com peróxido de hidrogênio (H2O2) e vários óxidos de metal..
Ácido carbónico
H2CO3 é formado graças à reação fotoquímica do dióxido de carbono com a água atmosférica.
Ácido clorídrico
O HCl representa apenas 2% da chuva ácida, e seu precursor é o cloreto de metila (ClCH3). Este composto vem dos oceanos e é oxidado pelos radicais OH para formar ácido clorídrico..
Precipitação
Uma vez que os compostos ácidos (ácido nítrico ou ácido sulfúrico e, em menor grau, ácido clorídrico) foram formados, eles precipitarão.
A precipitação pode ser por deposição das partículas suspensas nas quais a reação de acidificação ocorreu na fase gasosa. Outra maneira é que na chuva a água condensada onde os ácidos se formaram precipita.
Composição
A acidez natural da chuva é próxima a um pH de 5,6, embora em algumas áreas não contaminadas valores de 5. Esses baixos valores de pH têm sido associados à presença de ácidos de origem natural..
Considera-se que dependendo do nível de pH, a chuva pode ser classificada em:
a) Levemente ácido (pH entre 4,7 e 5,6)
b) Ácido médio (pH entre 4,3 e 4,7)
c) Fortemente ácido (pH menor ou igual a 4,3).
Se a chuva tiver concentração> 1,3 mg / L de nitratos e> 3 mg / L no caso de sulfatos, a contaminação é considerada alta.
A chuva ácida é composta em mais de dois terços dos casos pela presença de ácido sulfúrico, seguido em abundância por ácido nítrico. Outros componentes que podem contribuir para a acidez da chuva são o ácido clorídrico e o ácido carbônico..
Reações químicas da chuva ácida
Formação de ácido sulfúrico (H2SO4)
A produção de ácido sulfúrico pode ocorrer na fase gasosa ou na fase líquida.
Fase gasosa
Apenas 3-4% do SO2 é oxidado na fase gasosa para produzir ácido sulfúrico. Existem muitas rotas para a formação de ácido sulfúrico a partir de precursores gasosos, aqui é mostrada a reação do SO2 com o ozônio troposférico..
A reação ocorre em duas etapas:
1.- O dióxido de enxofre reage com o ozônio troposférico gerando trióxido de enxofre e liberando oxigênio.
SO2 + O3 = SO3 + O2
2.- Então o trióxido de enxofre é oxidado com vapor de água e produz ácido sulfúrico.
SO3 + H2O = H2SO4
Fase líquida
Nas gotas de água que vão formar a chuva, o ácido sulfúrico pode ser produzido de várias maneiras:
1.- O SO2 se dissolve na água gerando ácido sulfuroso, e este é oxidado pelo peróxido de hidrogênio:
SO2 + H2O = H2SO2
H2SO2 + H2O2 = H2SO4 + H2O
2.- Mecanismo fotocatalítico: Neste caso as partículas de óxido metálico (ferro, zinco, titânio) são ativadas graças à ação da luz solar (ativação fotoquímica) e oxidam SO2 gerando ácido sulfúrico.
Formação de ácido nítrico (HNO3)
O ozônio troposférico O3 produz a transformação de NO2 em HNO3 em um processo de três estágios:
1.- NO2 + O3 = NO3 + O2
2.- NO3 + NO2 = N2O5
3.- N2O5 + H2O = 2HNO3
Efeitos no meio ambiente

Acidificação do solo e seus efeitos na vegetação
O efeito da chuva ácida no solo varia de acordo com sua composição. Por exemplo, solos de origem calcária, basáltica e ígnea têm maior capacidade de neutralizar a acidez..
Já os solos ricos em quartzo como material inerte não são capazes de regular o teor de ácido. Assim, em solos onde a chuva ácida aumenta a acidez, íons metálicos tóxicos para plantas e animais são liberados e levados embora..
Um caso relevante é a dissolução de aluminossilicatos, que liberam íons de alumínio muito prejudiciais à vegetação..
Em geral, a acidez do solo diminui a disponibilidade de nutrientes para as plantas. Além disso, promove a liberação e lavagem do cálcio, o que causa deficiências nas plantas.
Efeito nos aquíferos e na saúde humana
Na maioria dos casos, a chuva ácida não tem aparência ou sabor diferente da chuva normal, nem gera sensações na pele. Seus efeitos na saúde humana são indiretos e raramente causa danos à pele devido à acidez extrema..
Um dos problemas da chuva ácida é que, ao baixar os valores de pH abaixo de 5, os metais pesados são liberados e levados embora. Esses poluentes como alumínio e cádmio podem entrar em aquíferos subterrâneos.
Se a água desses aquíferos contaminados passar para poços de consumo humano, pode causar sérios danos à saúde.
Deterioração de edifícios, monumentos e materiais

Pedras do tipo calcário
Construções, monumentos e esculturas em calcário ou mármore são severamente afetados pela chuva ácida. Isso é muito sério, já que muitos edifícios históricos e obras de arte são construídos com esses materiais..
No caso do calcário, a chuva ácida causa a dissolução do calcário e causa a recristalização da calcita. Essa recristalização produz tons esbranquiçados na superfície..
No caso específico da chuva com ácido sulfúrico, ocorre o fenômeno da sulfatação. Por meio desse processo, a superfície da rocha é transformada em gesso e liberado CO2..
O mármore, embora mais resistente, também é afetado pela chuva ácida. Nesse caso, ocorre a esfoliação da pedra, motivo pelo qual as camadas superficiais dela são destacadas..
Outros materiais não corrosivos
Em alguns edifícios a deterioração estrutural é mínima, mas também com efeitos negativos. Por exemplo, depósitos de ácido seco sujam as paredes, aumentando os custos de manutenção.
Metais
A chuva ácida causa corrosão dos metais devido ao fenômeno da oxidação. Isso causa enormes prejuízos econômicos, pois estruturas, equipamentos, máquinas e veículos com partes metálicas são gravemente afetados..
Flora e fauna

A chuva ácida modifica o equilíbrio natural dos ecossistemas aquáticos e terrestres.
Plantas e animais em corpos lênticos de água
Os corpos d'água lenticulares são mais suscetíveis à acidificação, porque são ecossistemas fechados. Além disso, o acúmulo de ácidos na água tem consequências negativas na vida que abriga..
Outra consequência da acidificação é a precipitação de nitratos pela chuva, que causa eutrofização nos corpos d'água. O excesso de nutrientes reduz o oxigênio disponível e afeta negativamente a sobrevivência dos animais aquáticos.
Outro efeito negativo indireto é o arrastamento de íons de metais pesados do ambiente terrestre para os corpos d'água. Esses íons são liberados no solo pela ação dos íons hidrônio quando a acidez aumenta..
Vegetação e disponibilidade de nutrientes
Os problemas mais graves causados pela acidificação do solo são a imobilidade dos nutrientes essenciais e o aumento dos metais tóxicos..
Por exemplo, o alumínio e o magnésio são liberados das partículas do solo ao serem substituídos por hidrogênio. O alumínio afeta a estrutura e função das raízes e reduz a absorção do cálcio essencial para as plantas.
Por outro lado, a acidificação do solo causa danos às micorrizas (fungos associados às raízes), essenciais na dinâmica da floresta..
Danos diretos a plantas e animais
O ácido sulfúrico causa danos diretos às folhas ao degradar a clorofila e produzir clorose (amarelecimento da folha). Em algumas espécies, o crescimento e a produção de sementes viáveis diminuem.
Os anfíbios (sapos e rãs) são particularmente suscetíveis aos efeitos da acidez da água. Alguns danos são lesões diretas e diminuição da defesa contra patógenos (especialmente fungos da pele).
Soluções
Reduza as emissões
O resultado final da chuva ácida é reduzir a liberação de precursores químicos para o meio ambiente. Os mais importantes são os óxidos de enxofre e nitrogênio.
No entanto, isso apresenta algumas dificuldades, pois implica afetar os interesses econômicos e de desenvolvimento de empresas e países. Por exemplo, uma das principais fontes de dióxido de enxofre é a queima de carvão, que representa mais de 70% da energia na China..
Existem algumas alternativas tecnológicas que podem ajudar a reduzir as emissões. Por exemplo, na indústria, os chamados “leitos fluidizados” incorporam absorventes (calcário ou dolomita) que retêm SO2. No caso de veículos motorizados e motores de combustão em geral, os conversores catalíticos em conformidade também ajudam a reduzir as emissões de SO2.
Por outro lado, alguns países têm implementado programas específicos de redução da chuva ácida. Por exemplo, os Estados Unidos desenvolveram o Programa Nacional de Avaliação de Precipitação de Ácido (NAPAP). Entre algumas das medidas contempladas pelo NAPAP está a implantação do uso de combustíveis com baixo teor de enxofre.
Outra medida possível é a substituição da frota por carros elétricos para reduzir a chuva ácida e o aquecimento global. No entanto, embora exista tecnologia para o conseguir, a pressão das indústrias automóvel e petrolífera atrasou as decisões a este respeito. Outros fatores que influenciam são os elementos culturais relacionados à velocidade que um veículo pretende atingir..
Aplicar medidas de correção de acidez
Em alguns casos, o pH dos solos e das águas pode ser aumentado pela adição de álcalis, por exemplo, pela incorporação de grandes quantidades de cal. No entanto, esta prática não é viável em grandes áreas de terra..
Proteção da superfície
Pedra
Existem vários métodos para proteger ou pelo menos reduzir a deterioração da pedra sob o efeito da chuva ácida. Um desses métodos é lavá-lo com vapor ou água quente..
Agentes químicos como ácido fluorídrico ou bifluoreto de amônio também podem ser usados. Depois de lavada, a pedra pode ser selada com a aplicação de produtos especiais que obstruem os poros, como o hidróxido de bário.
Metal
Superfícies de metal corroídas podem ser protegidas por revestimento com um metal não corrosivo, como o zinco..
Para isso, pode ser aplicada a eletrodeposição, ou a estrutura metálica a ser protegida pode ser imersa no metal protetor no estado líquido..
Referências
- Espada L e A. Sánchez (1995). Influência da chuva ácida na corrosão de metais. pp. 145-171. In: Sastre de Vicente M. (Coord.) Eletroquímica e ambiente no limiar do século XXI. Universidade da Corunha. Serviço de Publicações. La Coruña, Espanha.
- García-Ruiz G (2018). Proteção de estruturas de edifícios em ambientes corrosivos. Fim do Projeto de Graduação em Engenharia em Tecnologias Industriais. Universidade Politécnica de Cartagena. Escola Técnica Superior de Engenharia Industrial. Cartagena, Espanha. 75 p.
- Granados-Sánchez D, GF López-Ríos e MA Hernández-García (2010). Ecossistemas florestais e de chuva ácida… Série de Ciências Florestais e Ambientais da Revista Chapingo 16: 187-206.
- Likens GE, CT Driscoll e DC Buso (1996). Efeitos de longo prazo da chuva ácida: Resposta e recuperação de um ecossistema florestal. Science, 272; 244-246.
Likens GE e FH Bormann (1974). Chuva ácida: um sério problema ambiental regional. Science, 184: 1176-1179. - Schindler DW (1988). Efeitos da chuva ácida nos ecossistemas de água doce. Science, 239: 149-157.
- Vélez-Upegui JJ, MC Valencia-Giraldo, A Londoño-Carvajal, CM González-Duque, JP Mariscal-Moreno (2010). Poluição do ar e chuva ácida. Diagnóstico do fenômeno na cidade de Manizales. Faculdade de Engenharia e Arquitetura. Universidade nacional da Colômbia. Sede de Manizales. Editorial Blanecolor Ltda. Primeira edição. Manizales, Colômbia. 150 p.


Ainda sem comentários