
Características de Metarhizium anisopliae, taxonomia, morfologia
Metarhizium anisopliae é um fungo mitospórico ou anamórfico de reprodução assexuada, amplamente utilizado como entomopatógeno para controle biológico. Tem a capacidade de parasitar e eliminar uma grande variedade de pragas de insetos de várias plantas de importância agrícola..
Este fungo possui características especiais de adaptação para sobreviver de forma saprofítica na matéria orgânica e como parasita em insetos. A maioria dos insetos pragas de culturas comerciais são suscetíveis a serem atacados por esse fungo entomopatogênico..

Como organismo vivo saprofítico, está adaptado a diferentes ambientes onde desenvolve micélio, conidióforos e conídios. Essa capacidade facilita sua reprodução em nível de laboratório por meio de técnicas de propagação simples para serem utilizadas como um biocontrolador..
Na verdade, esse fungo entomopatogênico é o inimigo natural de um grande número de espécies de insetos em vários agroecossistemas. Os hospedeiros estão completamente cobertos por um micélio verde, em referência à doença chamada muscardina verde..
O ciclo de vida do entomopatógeno Metarhizium anisopliae É realizado em duas fases, uma fase infecciosa celular e outra fase saprofítica. O infeccioso dentro do inseto parasitado e no saprófito aproveita os nutrientes do cadáver para se multiplicar.
Ao contrário de patógenos como vírus e bactérias que precisam ser ingeridos pelo patógeno para agir, o fungo Metarhizium atua no contato. Nesse caso, os esporos podem germinar e penetrar no interior, infectando a membrana cuticular do hospedeiro..
Índice do artigo
- 1 recursos
- 2 Morfologia
- 3 Taxonomia
- 4 ciclo de vida
- 4.1 muscardina verde
- 5 Controle biológico
- 5.1 Modo de ação
- 6 Controle biológico do gorgulho da banana
- 7 Controle biológico de larvas
- 7.1 Fall Armyworm
- 7.2 Larvas de verme branco
- 8 referências
Caracteristicas
O Metarhizium anisopliae É um fungo patogênico de amplo espectro, localizado no solo e em restos de insetos parasitados. Devido ao seu potencial como alternativa ecológica, é o substituto ideal para os agroquímicos utilizados no manejo integral de pragas de importância econômica..
Infecção do M. anisopliae Começa com a união dos conídios do fungo à cutícula do inseto hospedeiro. Posteriormente, por meio da atividade enzimática entre as duas estruturas e a ação mecânica, ocorre a germinação e a penetração..
As enzimas que intervêm no reconhecimento, adesão e patogênese da cutícula do hospedeiro estão localizadas na parede celular do fungo. Essas proteínas incluem fosfolipases, proteases, dismutases e adesinas, que também atuam nos processos de adesão, osmose e morfogênese do fungo..
Geralmente, esses fungos têm ação lenta quando as condições ambientais são desfavoráveis. Temperaturas médias entre 24 e 28 ºC e alta umidade relativa são ideais para um efetivo desenvolvimento e ação entomopatogênica..
Doença da muscardina verde causada por M. anisopliae é caracterizada pela coloração verde dos esporos no hospedeiro colonizado. Uma vez que o inseto é invadido, o micélio cobre a superfície, onde as estruturas frutificam e esporulam, cobrindo a superfície do hospedeiro..
Nesse sentido, a infecção dura cerca de uma semana para que o inseto pare de se alimentar e morra. Entre as várias pragas que controla, é altamente eficaz em insetos da ordem Coleoptera, Lepidoptera e Homoptera, principalmente larvas..
O cogumelo M. anisopliae Como um biocontrolador, é comercializado em formulações de esporos misturados a materiais inertes para preservar sua viabilidade. A forma adequada para sua aplicação é através de fumigações, manipulação ambiental e inoculação.
Morfologia
Em nível de laboratório, colônias de M. anisopliae mostram um desenvolvimento eficaz em meios de cultura PDA (Papa-dextrorse-agar). A colônia circular apresenta um crescimento micelar branco inicialmente, exibindo variações de cor quando o fungo esporula..
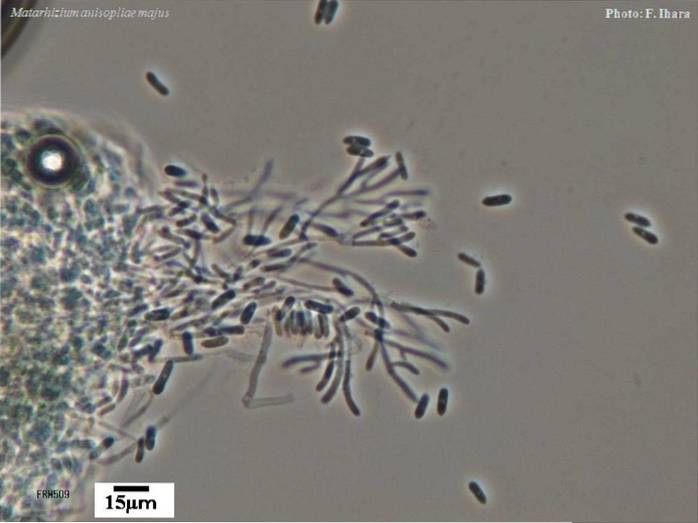
Quando o processo de multiplicação dos conídios começa, uma cor verde oliva é percebida na superfície micelar. Na parte inferior da cápsula, uma descoloração amarelo claro é observada com pigmentos amarelos difusos no meio.
Os conidióforos crescem do micélio de forma irregular com dois a três ramos em cada septo. Esses conidióforos têm comprimento de 4 a 14 mícrons e diâmetro de 1,5 a 2,5 mícrons..
As fiálides são estruturas que são geradas no micélio, sendo o local onde os conídios se destacam. Sobre M. anisopliae eles são finos no ápice, com 6 a 15 mícrons de comprimento e 2 a 5 mícrons de diâmetro.
Os conídios são estruturas unicelulares, cilíndricas e truncadas, com longas cadeias, hialinas a esverdeadas. Os conídios têm 4 a 10 mícrons de comprimento e 2 a 4 mícrons de diâmetro.
Taxonomia
O genero Metarhizium foi inicialmente descrito por Sorokin (1883) infectando larvas de Anisoplia austríaca, causando uma doença conhecida como muscardina verde. O nome Entomophthora anisopliae foi inicialmente proposto por Metschnikoff para isolados de fungos, posteriormente foi denominado Destruidor isaria.
Estudos mais detalhados da taxonomia do gênero, concluídos em classificá-lo como Metarhizium sorokin. Atualmente a espécie é considerada M. anisopliae, nomeado por Metschnikoff, como o organismo representativo do gênero Metarhizium.
Vários isolados do fungo Metarhizium são específicos, por isso foram designados como novas variedades. No entanto, eles são atualmente classificados como espécies Metarhizium anisopliae, Metarhizium majus Y Metarhizium acridum.
Da mesma forma, algumas espécies foram renomeadas, Metarhizium taii apresenta características semelhantes a Metarhizium guizhouense. Uma variedade comercial de M. anisopliae, a M. anisopliae (43) que é inimigo específico dos coleópteros agora é chamado Metarhizium brunneum.
As espécies Metarhizium anisopliae (Metchnikoff) Sorokin (1883), faz parte do gênero Metarhizium descrito por Sorokin (1883). Taxonomicamente pertence à família Clavicipitaceae, pedido Hipocreias, aula Sordariomycetes, divisão Ascomycota, do reino Fungi.
Ciclo de vida
O cogumelo Metarhizium anisopliae inicia a patogênese por meio do processo de adesão dos conídios à membrana cuticular do hospedeiro. Posteriormente, ocorrem as fases de germinação, crescimento de apressórios ou estruturas de inserção, colonização e reprodução..
Os esporos ou conídios do solo ou restos de insetos contaminados invadem a cutícula de novos hospedeiros. Com a intervenção de processos mecânicos e químicos, desenvolve-se o apressório e o tubo germinativo que penetra no interior do inseto..
Geralmente, em condições favoráveis, a germinação ocorre 12 horas após a inoculação. Da mesma forma, a formação de apressórios e a penetração do tubo germinativo ou haustórios ocorrem entre 12 a 18 horas..
O mecanismo físico que permite a penetração é a pressão exercida pelos apressórios, que rompem a membrana cuticular. O mecanismo químico é a ação das enzimas protease, quinase e lipase que quebram as membranas no local de inserção.
Assim que o inseto penetra, as hifas se ramificam para dentro, invadindo completamente a presa após 3-4 dias. Em seguida, as estruturas reprodutivas, conidióforos e conídios são formados, o que completa a patogênese do hospedeiro em 4-5 dias..
A morte do inseto ocorre pela contaminação de toxinas produzidas pelo fungo entomopatogênico. O biocontrolador sintetiza as toxinas dextruxina, protodextruxina e desmetildextruxina com alto nível de toxicidade para artrópodes e nematóides.
A invasão do hospedeiro está condicionada à temperatura e umidade relativa do ambiente. Da mesma forma, a disponibilidade de nutrientes na membrana cuticular do inseto e a capacidade de detectar hospedeiros suscetíveis de serem colonizados..
Muscardina verde
Doença da muscardina verde causada por Metarhizium anisopliae Apresenta vários sintomas em larvas infectadas, ninfas ou adultos. As formas imaturas reduzem a formação de mucilagem, tendem a se afastar do local de ataque ou paralisar seu movimento.
Os adultos diminuem seus movimentos e área de vôo, param de se alimentar e as fêmeas não põem ovos. Os insetos contaminados tendem a morrer em locais distantes do local da infecção, o que estimula a disseminação da doença.
O ciclo da doença pode durar entre 8 e 10 dias dependendo das condições ambientais, principalmente umidade e temperatura. Após a morte do hospedeiro, fica completamente coberto por um micélio branco e sucessivas esporulações verdes, características da muscardina verde..
Controle biológico
O cogumelo Metarhizium anisopliae é um dos entomopatógenos mais amplamente estudados e utilizados no controle biológico de pragas. O fator chave para o sucesso da colonização de um hospedeiro é a penetração do fungo e sua multiplicação..
Uma vez que o fungo se estabelece dentro do inseto, ocorre a proliferação de hifas filamentosas e a geração de micotoxinas que inativam o hospedeiro. A morte do hospedeiro também ocorre devido a alterações patológicas e efeitos mecânicos em órgãos e tecidos internos..
O controle biológico é realizado por meio da aplicação de produtos formulados a partir da concentração de esporos ou conídios do fungo em produtos comerciais. Os conídios são misturados com materiais inertes, como solventes, argilas, talcos, emulsificantes e outros aditivos naturais.
Esses materiais não devem afetar a viabilidade do fungo e devem ser inofensivos ao meio ambiente e à cultura. Além disso, devem apresentar ótimas condições físicas que facilitem a mistura, aplicação do produto e sejam de baixo custo..
O sucesso do controle biológico por meio de entomopatógenos depende da formulação eficaz do produto comercial. Incluindo a viabilidade do microrganismo, o material usado na formulação, as condições de armazenamento e o método de aplicação.
Modo de ação
O inóculo de aplicações de formulado com o fungo M. anisopliae Serve para contaminar larvas, hifas ou adultos. Hospedeiros contaminados migram para outros locais da cultura onde morrem e espalham a doença devido à esporulação do fungo.
A ação do vento, chuva e orvalho facilita a dispersão dos conídios para outras partes da planta. Os insetos em sua atividade de forrageamento são expostos à adesão de esporos.
As condições ambientais favorecem o desenvolvimento e a dispersão dos conídios, sendo os estágios imaturos do inseto os mais suscetíveis. A partir de novas infecções, são criados focos secundários, proliferando a epizootia capaz de controlar totalmente a praga..
Controle biológico do gorgulho da banana
O gorgulho preto (Cosmopolites sordidus Germar) é uma importante praga do cultivo de musaceae (banana e banana) principalmente nos trópicos. Sua dispersão é causada principalmente pelo manejo que o homem realiza nos processos de semeadura e colheita..

A larva é o agente causador dos danos causados no interior do rizoma. O gorgulho em sua fase larval é muito ativo e voraz, causando perfurações que afetam o sistema radicular da planta..
As galerias formadas no rizoma facilitam a contaminação com microrganismos que apodrecem os tecidos vasculares da planta. Além disso, a planta enfraquece e tende a tombar devido à ação de fortes ventos..
O controle usual é baseado no uso de inseticidas químicos, porém, seu efeito negativo sobre o meio ambiente tem levado à busca de novas alternativas. Atualmente o uso de fungos entomopatogênicos como Metarhizium anisopliae relataram bons resultados em testes de campo.
Excelentes resultados foram obtidos no Brasil e no Equador (85-95% de mortalidade) usando M. anisopliae no arroz como material de inoculação. A estratégia é colocar arroz infectado em pedaços do caule ao redor da planta, o inseto é atraído e fica contaminado com o patógeno.
Controle biológico de larvas
Verme do Exército de Outono
The Fall ArmywormSpodoptera frugiperda) é uma das pragas mais prejudiciais em cereais como sorgo, milho e forragens. No milho, é altamente prejudicial quando ataca a cultura antes dos 30 dias, com alturas entre 40 e 60 cm..

Nesse sentido, o controle químico tem permitido ao inseto maior resistência, eliminação de inimigos naturais e danos ao meio ambiente. O uso de M. anisopliae como alternativa de controle biológico tem reportado bons resultados, uma vez que S. frugiperda é suscetível.
Os melhores resultados têm sido obtidos quando se utiliza arroz esterilizado como meio de dispersão do inóculo na cultura. Realizando aplicações a 10 dds e depois aos 8 dias, ajustando a formulação em 1 × 1012 conídios por hectare.
Larvas de verme branco
As larvas de besouro são encontradas se alimentando de matéria orgânica e raízes de safras economicamente importantes. As espécies Hylamorpha elegans (Burmeister) chamado de galinha verde, seu estado larval é uma praga do trigo (Triticum aestivum EU.).

Os danos causados pelas larvas ocorrem ao nível do sistema radicular, fazendo com que as plantas enfraqueçam, murchem e percam as folhas. O ciclo de vida do besouro é de um ano, e na época de maior incidência, observam-se áreas de cultivo totalmente destruídas..
O controle químico tem se mostrado ineficaz devido à migração das larvas nos solos tratados. Associado ao aumento da resistência, aumento dos custos de produção e contaminação ambiental.
O emprego de Metarhizium anisopliae Como um agente antagonista e biocontrolador, atingiu até 50% de mortalidade nas populações de larvas. Mesmo que os resultados tenham sido obtidos em nível de laboratório, espera-se que as análises de campo relatem resultados semelhantes..
Referências
- Acuña Jiménez, M., García Gutiérrez, C., Rosas García, N. M., López Meyer, M., & Saínz Hernández, J. C. (2015). Formulação de Metarhizium anisopliae (Metschnikoff) Sorokin com polímeros biodegradáveis e sua virulência contra Heliothis virescens (Fabricius). International Journal of Environmental Pollution, 31 (3), 219-226.
- Arguedas, M., Álvarez, V., & Bonilla, R. (2008). Eficácia do fungo entomopatogênico "Metharrizium anisopliae"No controle de"Boophilus microplus”(Acari: ixodidae). Agronomia da Costa Rica: Journal of Agricultural Sciences, 32 (2), 137-147.
- Carballo, M. (2001). Opções para o manejo do gorgulho da banana. Manejo integrado de pragas (Costa Rica) Nº, 59.
- Castillo Zeno Salvador (2005) Uso de Metarhizium anisopliae para o controle biológico da cigarrinha (Aeneolamia spp. Y Prosapia spp.) em pastagens de Brachiaria decumbens em El Petén, Guatemala (Dissertação de Mestrado) Recuperado em: catie.ac.cr
- Greenfield, B. P., Lord, A. M., Dudley, E., & Butt, T. M. (2014). Conídios do fungo patogênico de inseto, Metarhizium anisopliae, não aderem à cutícula larval do mosquito. Ciência aberta da Royal Society, 1 (2), 140193.
- González-Castillo, M., Aguilar, C. N., & Rodríguez-Herrera, R. (2012). Controle de insetos-pragas na agricultura com fungos entomopatogênicos: desafios e perspectivas. Rev. Científico da Universidade Autônoma de Coahuila, 4 (8).
- Lezama, R., Molina, J., López, M., Pescador, A., Galindo, E., Ángel, C.A., & Michel, A.C. (2005). Efeito do fungo entomopatogênico Metarhizium anisopliae sobre o controle da lagarta do milho no campo. Avanços na Pesquisa Agrícola, 9 (1).
- Rodríguez, M., France, A., & Gerding, M. (2004). Avaliação de duas cepas do fungo Metarhizium Anisopliae var. Anisopliae (Metsh.) Para o controle de larvas do verme branco Hylamorpha elegans Burm. (Coleoptera: Scarabaeidae). Agricultura Técnica, 64 (1), 17-24.



Ainda sem comentários