
Estrutura do metoxietano, propriedades, obtenção, usos, riscos

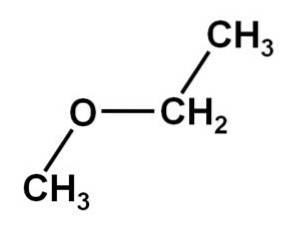
O metoxietano É um composto orgânico da família dos éteres ou alcóxidos. Sua fórmula química é CH3OCHdoisCH3. É também denominado éter metil etílico ou éter etilmetílico. É um composto gasoso à temperatura ambiente e sua molécula possui dois grupos metil -CH3, um diretamente ligado ao oxigênio e o outro ao etil -CHdoisCH3.
O metoxietano é um gás incolor, solúvel em água e miscível com éter e álcool etílico. Por ser um éter, é um composto de baixa reatividade; entretanto, pode reagir em altas temperaturas com alguns ácidos concentrados..
É geralmente obtido pela chamada síntese de Williamson, que compreende a utilização de um alcóxido de sódio e de um iodeto de alquila. Por sua vez, sua decomposição tem sido estudada sob várias condições.
O metoxietano é utilizado em laboratórios de pesquisa com diversos objetivos, por exemplo, no estudo de nanomateriais semicondutores ou na observação de matéria interestelar em constelações e grandes nuvens moleculares do universo..
Na verdade, graças a telescópios muito sensíveis (interferômetros), ele foi detectado em certos lugares do espaço interestelar..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades físicas
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 ponto de fulgor
- 3.6 Temperatura de autoignição
- 3.7 Peso Específico
- 3.8 Índice de refração
- 3.9 Solubilidade
- 4 propriedades químicas
- 4.1 Decomposição de calor
- 4.2 Decomposição fotossensibilizada
- 5 Obtendo
- 6 Localização no universo
- 7 usos de metoxietano
- 7.1 Para estudos sobre matéria interestelar
- 7.2 Para deduzir transformações químicas em vários campos de estudo
- 7.3 Uso potencial em semicondutores
- 8 riscos
- 9 referências
Estrutura
O composto de metoxietano tem um grupo metil -CH3 e um grupo etil -CHdoisCH3 ambos ligados a um oxigênio.
Como pode ser visto, nesta molécula existem dois grupos metil, um ligado ao oxigênio CH3-O e o outro pertencente a etil -CHdois-CH3.
No estado fundamental ou de baixa energia, o grupo metil de -CHdois-CH3 está em posição trans com relação ao metil ligado ao oxigênio, ou seja, em um lugar diametralmente oposto, tomando como referência a ligação CHdois-O. É por isso que às vezes é chamado trans-éter etilmetílico.
Esta molécula pode sofrer torção na ligação CHdois-Ou, o que coloca o metil em uma posição espacial diferente do trans , grupos metil -CH3 estão muito próximos uns dos outros e esta torção gera uma transição de energia detectável por instrumentos sensíveis.
Nomenclatura
- Metoxietano.
- Éter metil etílico.
- trans-Éter etilmetílico (principalmente na literatura de língua inglesa, tradução do inglês trans-éter etilmetílico).
Propriedades físicas
Estado físico
Gás incolor
Peso molecular
60,096 g / mol
Ponto de fusão
-113,0 ºC
Ponto de ebulição
7,4 ºC
Ponto de inflamação
1,7 ºC (método de copo fechado).
Temperatura de autoignição
190 ºC
Peso específico
0,7251 a 0 ºC / 0 ºC (é menos denso que a água, mas mais pesado que o ar).
Índice de refração
1,3420 a 4 ºC
Solubilidade
Solúvel em água: 0,83 mol / L
Solúvel em acetona. Miscível com álcool etílico e éter etílico.
Propriedades quimicas
O metoxietano é um éter, portanto, é relativamente não reativo. A ligação carbono-oxigênio-carbono C-O-C é muito estável contra bases, agentes oxidantes e redutores. Só é degradado por ácidos, mas só procede em condições vigorosas, ou seja, com ácidos concentrados e altas temperaturas..
No entanto, tende a oxidar na presença de ar, formando peróxidos instáveis. Se os recipientes que o contêm forem expostos ao calor ou fogo, os recipientes explodem violentamente.
Decomposição de calor
Quando o metoxietano é aquecido entre 450 e 550 ° C, ele se decompõe em acetaldeído, etano e metano. Essa reação é catalisada pela presença de iodeto de etila, que geralmente está presente em amostras de metoxietano de laboratório porque é utilizado para sua obtenção..
Decomposição fotossensibilizada
O metoxietano irradiado com uma lâmpada de vapor de mercúrio (comprimento de onda de 2537 Å) se decompõe gerando uma ampla variedade de compostos, incluindo: hidrogênio, 2,3-dimetoxibutano, 1-etoxi-2-metoxipropano e metil vinil éter..
Os produtos finais dependem do tempo de irradiação da amostra, pois à medida que a irradiação continua, aqueles que se formam inicialmente dão origem a novos compostos..
Ao prolongar o tempo de irradiação, propano, metanol, etanol, acetona, 2-butanona, monóxido de carbono, éter etil-n-propílico e éter metil-sec-butílico também podem ser formados..
Obtendo
Por ser um éter não simétrico, o metoxietano pode ser obtido pela reação entre o metóxido de sódio CH3ONa e iodeto de etila CH3CHdoisI. Este tipo de reação é chamada de síntese de Williamson.
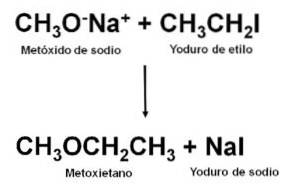
Uma vez realizada a reação, a mistura é destilada para obter o éter.
Também pode ser obtido usando etóxido de sódio CH3CHdoisONa e sulfato de metila (CH3)doisSW4.
Localização no universo
O trans-O éter etilmetílico foi detectado no meio interestelar em regiões como a constelação de Orion KL e na nuvem molecular gigante W51e2.

A detecção deste composto no espaço interestelar juntamente com a análise de sua abundância está ajudando a construir modelos de química interestelar..
Usos de metoxietano
Metoxietano ou éter metil etílico é usado principalmente em experimentos de laboratório para pesquisas científicas.
Para estudos sobre matéria interestelar
Por ser uma molécula orgânica com rotações internas, o metoxietano é um composto químico de interesse para estudos da matéria interestelar..
As rotações internas de seus grupos metil produzem transições de energia na região de microondas.
Portanto, eles podem ser detectados por telescópios altamente sensíveis, como o Atacama Large Millimeter / submillimeter Ensemble, ou ALMA. Atacama Large Millimeter / submillimeter Array).

Graças à sua rotação interna e aos grandes observatórios espaciais, o trans-O éter metil etílico foi encontrado na constelação de Órion e na nuvem molecular gigante W51e2.
Para deduzir transformações químicas em vários campos de estudo
Alguns pesquisadores observaram a formação de metoxietano ou éter metil etílico quando uma mistura de etileno CH é irradiada com elétrons.dois= CHdois e metanol CH3Oh.
O mecanismo de reação passa pela formação do radical CH3O •, que ataca a ligação dupla rica em elétrons de CHdois= CHdois. O aduto CH resultante3-O-CHdois-CHdois• captura um hidrogênio de um CH3OH e forma o éter metil etílico CH3-O-CHdois-CH3.
O estudo deste tipo de reações induzidas pela irradiação de elétrons é útil no campo da bioquímica por ter sido determinado que podem causar danos ao DNA, ou no campo da química organometálica por favorecer a formação de nanoestruturas..
Além disso, sabe-se que grandes quantidades de elétrons secundários são produzidos quando a radiação eletromagnética ou particulada interage com a matéria condensada no espaço..
Portanto, estima-se que esses elétrons podem iniciar transformações químicas na poeira interestelar. Daí a importância de estudar o éter metil etílico nessas reações..
Uso potencial em semicondutores
Por meio de métodos de cálculo computacional, alguns cientistas descobriram que o metoxietano ou o éter metil etílico podem ser adsorvidos por grafeno dopado com gálio (Ga) (observe que a adsorção é diferente da absorção).
O grafeno é um nanomaterial composto de átomos de carbono dispostos em um padrão hexagonal..

A adsorção de metoxietano no grafeno dopado ocorre por meio da interação entre o oxigênio do éter e o átomo de gálio na superfície do nanomaterial. Devido a essa adsorção, há uma transferência de carga líquida do éter para o gálio..
Após a adsorção de éter metil etílico e devido a esta transferência de carga, o grafeno dopado com gálio exibe propriedades semicondutoras do tipo p.
Riscos
Metoxietano é altamente inflamável.
Quando em contato com o ar, tem tendência a formar peróxidos instáveis e explosivos.
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Éter etilmetílico. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Irvine W.M. (2019) Éter etilmetílico (CdoisH5OCH3) Em: Gargaud M. et al. (eds). Enciclopédia de Astrobiologia. Springer, Berlim, Heidelberg. Recuperado de link.springer.com.
- Terceiro, B. et al. (2015). Procurando por éter etilmetílico trans em Orion KL Astronomia e Astrofísica. 582, L1 (2015). Recuperado de ncbi.nlm.nih.gov.
- Filseth, S.V. (1969). O Mercúrio 6 (3P1) Decomposição fotossensibilizada de éter metil etílico. The Journal of Physical Chemistry. Volume 73, Número 4, abril de 1969, 793-797. Recuperado de pubs.acs.org.
- Casanova, J.Jr. (1963). Preparação e manipulação do aluno de um gás-metil etil éter. Journal of Chemical Education. Volume 40, número 1, janeiro de 1963. Recuperado de pubs.acs.org.
- Ure, W. e Young, J.T. (1933a). Sobre o mecanismo de reações gasosas. I. A decomposição térmica do éter metil etílico. The Journal of Physical Chemistry, Vol. XXXVII, No. 9: 1169-1182. Recuperado de pubs.acs.org.
- Ure, W. e Young, J.T. (1933b). Sobre o mecanismo de reações gasosas. II. Catálise homogênea na decomposição do éter metil etílico. The Journal of Physical Chemistry, 37, 9, 1183-1190. Recuperado de pubs.acs.org.
- Shokuhi Rad, A. et al. (2017). Estudo DFT sobre a adsorção de dietil, etil metil e dimetil éteres na superfície de grafeno dopado com Gálio Ciência Aplicada de Superfícies. Volume 401, 15 de abril de 2017, páginas 156-161. Recuperado de sciencedirect.com.
- Schmidt, F. et al. (2019). Formação induzida por elétrons de éter etilmetílico em misturas condensadas de metanol e etileno. J. Phys. Chem. A 2019, 123, 1, 37-47. Recuperado de pubs.acs.org.


Ainda sem comentários