
Microfilamentos característicos, estrutura, funções, patologia
O microfilamentos ou filamentos de actina, são um dos três componentes fundamentais do citoesqueleto das células eucarióticas (microfilamentos, microtúbulos e filamentos intermediários) e são compostos por pequenos filamentos de uma proteína chamada actina (polímeros de actina).
Em eucariotos, os genes que codificam para microfilamentos de actina são altamente conservados em todos os organismos, razão pela qual eles são frequentemente usados como marcadores moleculares para estudos de vários tipos.

Os microfilamentos são distribuídos por todo o citosol, mas são especialmente abundantes na região subjacente à membrana plasmática, onde formam uma rede complexa e se associam a outras proteínas especiais para formar o citoesqueleto..
Redes de microfilamento no citoplasma de células de mamíferos são codificadas por dois dos seis genes descritos para a actina, que estão envolvidos na dinâmica do microfilamento e são até muito importantes durante a diferenciação de células-tronco.
Muitos autores concordam que os microfilamentos são as proteínas mais diversas, versáteis e importantes no citoesqueleto da maioria das células eucarióticas, e é importante lembrar que não são encontradas em microrganismos procarióticos..
Nesse tipo de células, por outro lado, existem filamentos homólogos aos microfilamentos, mas que são constituídos por outra proteína: a proteína MreB..
No momento, o gene que codifica essa proteína é considerado um possível gene ancestral para a actina eucariótica. No entanto, a homologia de sequência dos aminoácidos que compõem a proteína MreB é de apenas 15% em relação à sequência de actina.
Por serem uma parte fundamental do citoesqueleto, qualquer defeito fenotípico tanto nos microtúbulos quanto nos filamentos intermediários e nos microfilamentos de actina (citoesqueleto) pode causar diferentes patologias celulares e sistêmicas.
Índice do artigo
- 1 Características e estrutura
- 1.1 Organização
- 2 Como os filamentos de actina são formados?
- 2.1 Regulamento
- 3 funções
- 3.1 Exemplo de funções no fígado
- 4 patologias relacionadas
- 5 referências
Características e estrutura
Os microfilamentos são constituídos por monômeros de proteínas da família das actinas, que são proteínas contráteis altamente abundantes nas células eucarióticas, uma vez que também participam da contração muscular..
Esses filamentos têm um diâmetro entre 5 e 7 nm, por isso também são conhecidos como filamentos finos e são compostos por duas formas de actina: a forma globular (G actina) e a forma filamentosa (F actina)..
As proteínas que participam do citoesqueleto são conhecidas como γ e β actinas, enquanto aquelas que participam da contração são geralmente α actinas..
A proporção de actina globular e actina filamentosa no citosol depende das necessidades celulares, uma vez que os microfilamentos são estruturas altamente variáveis e versáteis, que estão em constante crescimento e encurtamento por polimerização e despolimerização..
G actina é uma pequena proteína globular, composta por quase 400 aminoácidos e com peso molecular em torno de 43 kDa.
Os monômeros de G-actina que compõem os microfilamentos são arranjados na forma de um filamento helicoidal, uma vez que cada um sofre uma torção quando associado ao próximo.
G actina associa-se a uma molécula de Ca2 + e outra de ATP, que estabilizam sua forma globular; enquanto a F-actina é obtida após a hidrólise do fosfato terminal da molécula de ATP em G-actina, que contribui para a polimerização.
Organização
Os filamentos de actina podem ser organizados em "feixes" ou "redes" que têm funções diferentes dentro das células. Os feixes formam estruturas paralelas ligadas por pontes cruzadas bastante rígidas.
As redes, por outro lado, são estruturas mais soltas, como malhas tridimensionais com propriedades de géis semissólidos..
Existem muitas proteínas que estão associadas a filamentos ou microfilamentos de actina e são conhecidas como ABP (do inglês proteínas de ligação à actina), que têm sites específicos para isso.
Muitas dessas proteínas permitem que os microfilamentos interajam com os outros dois componentes do citoesqueleto: microtúbulos e filamentos intermediários, bem como com os outros componentes da face interna da membrana plasmática..
Outras proteínas com as quais os microfilamentos interagem incluem as lâminas nucleares e a espectrina (nos glóbulos vermelhos).
Como os filamentos de actina são formados?
Como os monômeros de actina globulares sempre se ligam da mesma maneira, orientados na mesma direção, os microfilamentos têm uma polaridade definida, com duas extremidades: uma "mais" e outra "menos"..
A polaridade desses filamentos é muito importante, pois eles crescem consideravelmente mais rápido em sua extremidade positiva, onde os novos monômeros de G-actina são adicionados..

A primeira coisa que ocorre durante a polimerização dos filamentos de actina é um processo conhecido como “nucleação”, que consiste na associação de três monômeros da proteína.
Novos monômeros são adicionados a este trímero em ambas as extremidades, para que o filamento cresça. Monômeros de G-actina são capazes de hidrolisar ATP com cada ligação, o que tem implicações para a taxa de polimerização, uma vez que as frações de actina-ATP se dissociam com maior dificuldade do que as frações de actina-ADP..
O ATP não é necessário para a polimerização e o papel específico de sua hidrólise ainda não foi elucidado..
Alguns autores consideram que, como os eventos de polimerização da actina são rapidamente reversíveis, o ATP associado a esses processos pode representar até 40% do turnover celular total dessa molécula de energia..
Regulamento
Tanto a polimerização dos filamentos de actina quanto sua despolimerização são processos altamente regulados por uma série de proteínas específicas, responsáveis pela remodelação dos filamentos..
Um exemplo das proteínas que regulam a despolimerização são o fator de despolimerização da actina cofilina. Outra proteína, a profilina, tem função oposta, pois estimula a associação de monômeros (ao estimular a troca de ADP por ATP).
Características
Os microfilamentos interagem com os filamentos de miosina que estão associados às proteínas transmembrana que possuem um domínio no citosol e outro no exterior da célula, participando assim dos processos de mobilidade celular..
Esses microfilamentos associados à membrana plasmática medeiam várias respostas celulares a diferentes classes de estímulos. Por exemplo, a adesão celular em tecidos epiteliais é conduzida por proteínas transmembrana conhecidas como caderinas, que interagem com microfilamentos para recrutar fatores de resposta..
Os filamentos de actina interagem com os filamentos intermediários para fazer com que os estímulos extracelulares sejam transmitidos para locais-chave, como ribossomos e cromossomos dentro do núcleo..
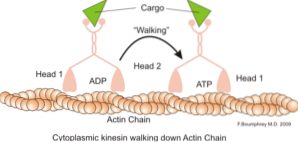
Uma função clássica e muito estudada dos microfilamentos é sua capacidade de formar "pontes", "trilhos" ou "rodovias" para o movimento da proteína motora miosina I, que é capaz de carregar vesículas de transporte das organelas para a membrana plasmática na secreção caminhos.
Os microfilamentos também interagem com a miosina II para estabelecer o anel contrátil que se forma durante a citocinese, justamente durante o último estágio da divisão celular em que o citosol é separado das células-tronco e filhas..
Em geral, os microfilamentos de F-actina modulam a distribuição de algumas organelas, como o complexo de Golgi, retículo endoplasmático e mitocôndria. Além disso, eles também participam do posicionamento espacial dos mRNAs para que sejam lidos pelos ribossomos..
Todo o conjunto celular de microfilamentos, especialmente aqueles que estão intimamente relacionados à membrana plasmática, participam da formação das membranas ondulantes das células que têm um movimento ativo constante..
Eles também estão envolvidos na formação de microvilosidades e outras saliências comuns na superfície de muitas células..
Exemplo de funções no fígado
Os microfilamentos participam do processo de secreção biliar nos hepatócitos (células do fígado) e também nos movimentos peristálticos (contração coordenada) dos canalículos hepáticos.
Eles contribuem para a diferenciação dos domínios da membrana plasmática graças à sua associação com diferentes elementos citosólicos e ao controle que exercem sobre a topografia desses elementos intracelulares..
Patologias relacionadas
Existem poucas doenças associadas a defeitos primários na estrutura ou a proteínas e enzimas regulatórias na síntese de microfilamentos, apesar de estarem diretamente envolvidas em um grande número de funções..
O baixo índice de doenças e malformações na estrutura primária dos microfilamentos se deve ao fato de que, geralmente, existem múltiplos genes que codificam tanto a actina quanto suas proteínas regulatórias, fenômeno conhecido como "redundância genética".
Uma das patologias mais estudadas é a vitrificação dos oócitos em seu citoesqueleto, onde se observa uma interrupção na rede de microfilamentos corticais, bem como uma despolimerização e desorganização dos microtúbulos do fuso mitótico..
Em termos gerais, essa vitrificação causa uma dispersão cromossômica, pois leva a um desarranjo na compactação de toda a cromatina..
As células que apresentam maior organização e proporção de microfilamentos em seu citoesqueleto são as células do músculo estriado, portanto, a maioria das patologias está associada ao mau funcionamento do aparelho contrátil..
Microfilamentos defeituosos ou atípicos também foram associados à doença óssea conhecida como doença de Paget..
Referências
- Aguilar-Cuenca, R., Llorente-González, C., Vicente, C., & Vicente-Manzanares, M. (2017). A dinâmica de adesão coordenada por microfilamento conduz a migração de uma única célula e molda tecidos inteiros. F1000Research, 6.
- Dos Remedios, C. G., Chhabra, D., Kekic, M., Dedova, I. V., Tsubakihara, M., Berry, D. A., & Nosworthy, N. J. (2003). Proteínas de ligação de actina: regulação dos microfilamentos do citoesqueleto. Avaliações fisiológicas, 83(2), 433-473.
- Guo, H., Fauci, L., Shelley, M., & Kanso, E. (2018). Bistabilidade na sincronização de microfilamentos atuados. Journal of Fluid Mechanics, 836, 304-323.
- Lanza, R., Langer, R., & Vacanti, J. P. (Eds.). (2011). Princípios de engenharia de tecidos. Imprensa acadêmica.
- Robbins, J. (2017). Doenças do citoesqueleto: as desminopatias. In Cardioskeletal Myopathies in Children and Young Adultos (pp. 173-192). Academic Press.

Ainda sem comentários