
Modelo atômico de Heisenberg

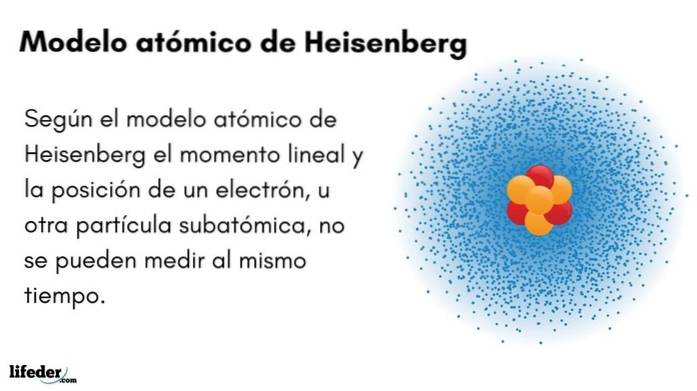
Qual é o modelo atômico de Heisenberg?
O Modelo atômico de Heisenberg (1927) introduz o princípio da incerteza nos orbitais de elétrons ao redor do núcleo atômico. O proeminente físico alemão lançou as bases da mecânica quântica para estimar o comportamento das partículas subatômicas que compõem um átomo.
O princípio da incerteza de Werner Heisenberg indica que não é possível saber com certeza a posição e o momento linear de um elétron ao mesmo tempo. O mesmo princípio se aplica às variáveis tempo e energia; ou seja, se tivermos uma pista sobre a posição do elétron, não saberemos o momento linear do elétron e vice-versa.
Em suma, não é possível prever simultaneamente o valor de ambas as variáveis. O exposto não implica que nenhuma das quantidades acima mencionadas possa ser conhecida com precisão. Desde que isoladamente, não há impedimento para a obtenção do valor dos juros.
No entanto, a incerteza ocorre quando se trata de conhecer simultaneamente duas grandezas conjugadas, como posição e momento linear, e tempo junto com a energia..
Este princípio surge devido a um raciocínio estritamente teórico, como única explicação viável para justificar observações científicas..
Características do modelo atômico de Heisenberg

Em março de 1927, Heisenberg publicou seu trabalho Sobre o conteúdo perceptual da cinemática e da mecânica quântica, onde você detalhou o princípio da incerteza ou indeterminação.
Este princípio, fundamental no modelo atômico proposto por Heisenberg, é caracterizado pelo seguinte:
- O princípio da incerteza surge como uma explicação que complementa as novas teorias atômicas sobre o comportamento dos elétrons. Apesar de utilizar instrumentos de medição com alta precisão e sensibilidade, a indeterminação ainda está presente em qualquer teste experimental.
- Devido ao princípio da incerteza, ao analisar duas variáveis relacionadas, se você tiver um conhecimento preciso de uma delas, então a incerteza sobre o valor da outra variável será cada vez maior..
- O momento e a posição de um elétron, ou outra partícula subatômica, não podem ser medidos ao mesmo tempo.
- A relação entre as duas variáveis é dada por uma desigualdade. Segundo Heisenberg, o produto das variações do momento linear e da posição da partícula é sempre maior que o quociente entre a constante de Plank (6,62606957 (29) × 10 -3. 4 Jules x segundos) e 4π, conforme detalhado na seguinte expressão matemática:

A legenda correspondente a esta expressão é a seguinte:
∆p: indeterminação do momento linear.
∆x: indeterminação de posição.
h: constante de Plank.
π: número pi 3,14.
- Diante do exposto, o produto das incertezas tem como limite inferior a razão h / 4π, que é um valor constante. Portanto, se uma das magnitudes tende a zero, a outra deve aumentar na mesma proporção.
- Esta relação é válida para todos os pares de quantidades canônicas conjugadas. Por exemplo: o princípio da incerteza de Heisenberg é perfeitamente aplicável ao par energia-tempo, conforme detalhado abaixo:
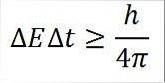
Nesta expressão:
∆E: indeterminação de energia.
∆t: indeterminação de tempo.
h: constante de Plank.
π: número pi 3,14.
- Deste modelo segue-se que o determinismo causal absoluto em variáveis canônicas conjugadas é impossível, pois para estabelecer esta relação deve-se ter conhecimento dos valores iniciais das variáveis de estudo..
- Consequentemente, o modelo de Heisenberg é baseado em formulações probabilísticas, devido à aleatoriedade que existe entre as variáveis em níveis subatômicos..
Testes Experimentais
O princípio da incerteza de Heisenberg surge como a única explicação possível para os testes experimentais que ocorreram durante as primeiras três décadas do século XXI..
Antes de Heisenberg enunciar o princípio da incerteza, os preceitos vigentes na época sugeriam que as variáveis momento linear, posição, momento angular, tempo, energia, entre outras, para partículas subatômicas fossem definidas operacionalmente.
Isso significava que eram tratados como se fossem física clássica; ou seja, um valor inicial foi medido e o valor final foi estimado de acordo com o procedimento pré-estabelecido.
Isto implicou a definição de um sistema de referência para as medições, o instrumento de medição e a forma de utilização do referido instrumento, de acordo com o método científico..
Conseqüentemente, as variáveis descritas pelas partículas subatômicas deveriam se comportar de maneira determinística. Ou seja, seu comportamento tinha que ser previsto com precisão e precisão..
Porém, cada vez que era realizado um teste desta natureza, era impossível obter o valor estimado teoricamente na medição..
As medidas foram distorcidas devido às condições naturais do experimento, e o resultado obtido não serviu para enriquecer a teoria atômica..
Exemplo
Por exemplo: se se trata de medir a velocidade e a posição de um elétron, o set-up do experimento deve contemplar a colisão de um fóton de luz com o elétron..
Essa colisão induz uma variação na velocidade e na posição intrínseca do elétron, com a qual o objeto de medição é alterado pelas condições experimentais..
Portanto, o pesquisador incentiva a ocorrência de um erro experimental inevitável, apesar da exatidão e precisão dos instrumentos utilizados..
Mecânica quântica diferente da mecânica clássica
Além do acima exposto, o princípio de indeterminação de Heisenberg afirma que, por definição, a mecânica quântica funciona de forma diferente da mecânica clássica.
Consequentemente, presume-se que o conhecimento preciso das medições no nível subatômico é limitado pela linha tênue que separa a mecânica clássica da quântica..
Limitações do modelo de Heisenberg
Apesar de explicar a indeterminação das partículas subatômicas e estabelecer as diferenças entre a mecânica clássica e quântica, o modelo atômico de Heisenberg não estabelece uma única equação para explicar a aleatoriedade desse tipo de fenômeno..
Além disso, o fato de a relação ser estabelecida por meio de uma desigualdade implica que a gama de possibilidades para o produto de duas variáveis canônicas conjugadas é indeterminada. Conseqüentemente, a incerteza inerente aos processos subatômicos é significativa..
Artigos de interesse
Modelo atômico de Schrödinger.
Modelo Atomic de Broglie.
Chadwick Atomic Model.
Modelo atômico de Perrin.
Modelo atômico de Thomson.
Modelo atômico Dalton.
Modelo atômico de Dirac Jordan.
Modelo atômico de Demócrito.
Modelo atômico de Leucippus.
Modelo atômico de Bohr.
Modelo atômico de Sommerfeld.
Modelo atômico atual.
Referências
- Beyler, R. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Recuperado de: britannica.com
- O Princípio da Incerteza de Heisenberg (s.f.). Recuperado de: hiru.eus
- García, J. (2012). Princípio da incerteza de Heisenberg. Recuperado de: hiberus.com
- Modelos atômicos (s.f.). Universidade Nacional Autônoma do México. Mexico DF, Mexico. Recuperado de: asesorias.cuautitlan2.unam.mx
- Werner Heisenberg (s.f.). Recuperado de: the-history-of-the-atom.wikispaces.com
- Wikipedia, The Free Encyclopedia (2018). A constante de Plank. Recuperado de: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2018). A relação de indeterminação de Heisenberg. Recuperado de: es.wikipedia.org

Ainda sem comentários