
História do modelo atômico de Rutherford, experimentos, postulados

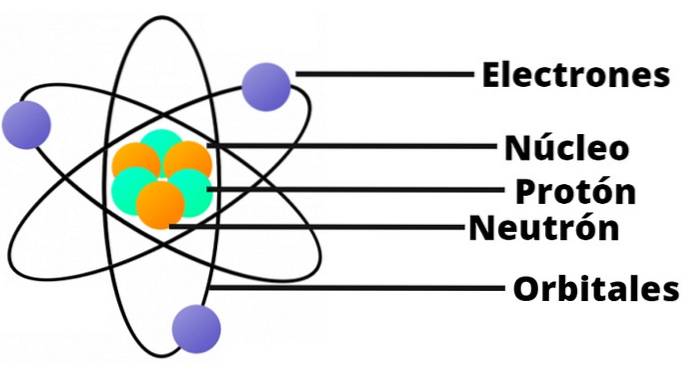
O Modelo atômico de Rutherford é a descrição do átomo criada pelo físico britânico Ernest Rutherford (1871-1937) quando em 1911 descobriu o núcleo atômico, graças aos famosos experimentos de espalhamento que levam seu nome.
A ideia do átomo (“indivisívelEm grego) como o menor componente da matéria, foi uma criação intelectual nascida na Grécia Antiga, por volta de 300 AC. Como tantos outros conceitos gregos, o conceito de átomo é desenvolvido com base na lógica e na argumentação, mas não na experimentação..
Os filósofos atomistas mais notáveis foram Demócrito de Abdera (460-360 aC), Epicuro de Samos (341-270 aC) e Tito Lucrécio (98-54 aC). Os gregos conceberam quatro tipos diferentes de átomos que correspondiam aos quatro elementos que segundo eles constituíam a matéria: ar, água, terra e fogo..
Mais tarde, Aristóteles acrescentaria um quinto elemento: o éter que formava as estrelas, já que os outros quatro elementos eram puramente terrestres..
As conquistas de Alexandre, o Grande, de quem Aristóteles foi mestre, expandiram suas crenças por todo o mundo antigo, da Espanha à Índia e, assim, durante séculos, a ideia de átomo estava criando um lugar próprio no mundo da ciência.
Índice do artigo
- 1 O átomo não é mais indivisível
- 1.1 tubo de Crookes
- 2 A descoberta do elétron
- 3 experimentos de espalhamento de Rutherford: o núcleo atômico e o próton
- 3.1 Observações
- 4 postulados do modelo atômico de Rutherford
- 5 limitações
- 6 artigos de interesse
- 7 referências
O átomo não é mais indivisível
As idéias dos filósofos gregos sobre a estrutura da matéria se mantiveram verdadeiras por centenas de anos, até que um químico e professor inglês chamado John Dalton (1776-1844) publicou os resultados de seus experimentos em 1808..
Dalton concordou que os elementos são feitos de partículas extremamente pequenas, chamadas átomos. Mas ele foi além ao afirmar que todos os átomos de um mesmo elemento são iguais, têm o mesmo tamanho, a mesma massa e as mesmas propriedades químicas, o que os faz permanecer inalterados durante uma reação química..
Este é o primeiro modelo atômico com base científica. Como os gregos, Dalton continuou a considerar o átomo indivisível, portanto sem estrutura. No entanto, a genialidade de Dalton o levou a observar um dos grandes princípios de conservação da Física:
- Em reações químicas, átomos não são criados nem destruídos, eles apenas mudam sua distribuição.
E ele estabeleceu a maneira pela qual os compostos químicos eram formados por "átomos compostos" (moléculas):
- Quando dois ou mais átomos de elementos diferentes se combinam para formar o mesmo composto, eles sempre o fazem em proporções de massa definitivo e constante.
O século 19 foi o grande século da eletricidade e do magnetismo. Alguns anos depois das publicações de Dalton, os resultados de alguns experimentos lançaram dúvidas sobre os cientistas sobre a indivisibilidade do átomo..
Tubo de crookes
O tubo de Crookes foi um dispositivo projetado pelo químico e meteorologista britânico William Crookes (1832-1919). O experimento que Crookes realizou em 1875, consistia em colocar, dentro de um tubo cheio de gás a baixa pressão, dois eletrodos, um deles denominado cátodo e outro chamado ânodo.
Ao estabelecer uma diferença de potencial entre os dois eletrodos, o gás brilhou com uma cor que era característica do gás usado. Esse fato sugeria que havia uma certa organização particular dentro do átomo e que, portanto, ele não era indivisível..
Além disso, essa radiação produziu uma fluorescência fraca na parede do tubo de vidro na frente do cátodo, cortando a sombra de uma marca em forma de cruz localizada dentro do tubo.
Era uma radiação misteriosa conhecida como "raios catódicos", que viajava em linha reta até o ânodo e era altamente energética, capaz de produzir efeitos mecânicos, e que era desviada em direção a uma placa carregada positivamente ou também por meio de ímãs..
A descoberta do elétron
A radiação dentro do tubo de Crookes não poderia ser ondas, pois carregava uma carga negativa. Joseph John Thomson (1856 - 1940) deu a resposta em 1887 quando encontrou a relação entre a carga e a massa desta radiação, e descobriu que era sempre a mesma: 1,76 x 10onze C / Kg., Independentemente do gás encerrado no tubo ou do material usado para fabricar o cátodo.
Thomson chamou essas partículas corpúsculos. Ao medir sua massa em relação à carga elétrica, ele concluiu que cada corpúsculo era muito menor do que um átomo. Portanto, ele sugeriu que eles deveriam fazer parte destes, descobrindo assim o elétron.
O cientista britânico foi o primeiro a esboçar um modelo gráfico do átomo, desenhando uma esfera com pontas inseridas, que devido ao seu formato recebeu o apelido de "pudim de ameixa". Mas esta descoberta levantou outras questões:
- Se a matéria é neutra e o elétron tem carga negativa: em qual parte do átomo está a carga positiva que neutraliza os elétrons??
- Se a massa do elétron é menor que a do átomo, então em que consiste o resto do átomo??
- Por que as partículas assim obtidas eram sempre elétrons e nunca de outro tipo??
Experimentos de espalhamento de Rutherford: o núcleo atômico e o próton
Em 1898, Rutherford identificou dois tipos de radiação do urânio, que ele chamou alfa Y beta.
A radioatividade natural já havia sido descoberta por Marie Curie em 1896. As partículas alfa têm carga positiva e são simplesmente núcleos de hélio, mas naquela época o conceito de núcleo ainda não era conhecido. Rutherford estava prestes a descobrir.
Uma das experiências que Rutherford realizou em 1911 na Universidade de Manchester, com a ajuda de Hans Geiger, consistiu em bombardear uma fina folha de ouro com partículas alfa, cuja carga é positiva. Ao redor da folha de ouro ele colocou uma tela fluorescente que permitiu visualizar os efeitos do bombardeio..
Observações
Estudando os impactos na tela fluorescente, Rutherford e seus assistentes observaram que:
- Uma porcentagem muito alta de partículas alfa passou pela folha sem desvio perceptível.
- Alguns desviaram em ângulos bastante íngremes
- E muito poucos voltaram atrás
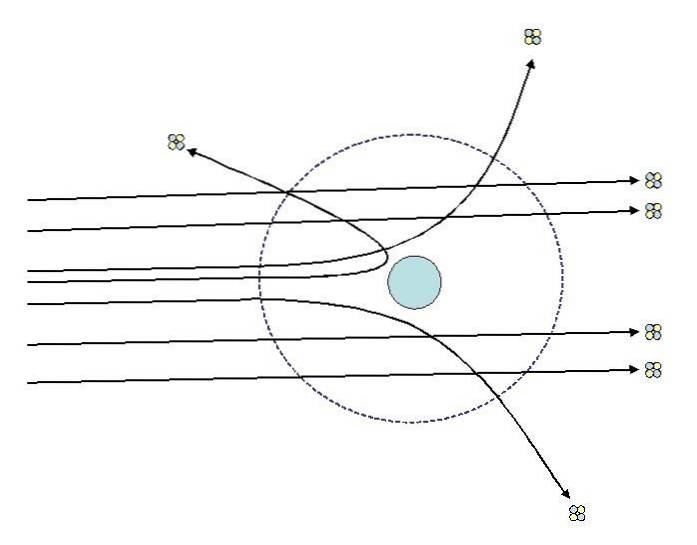
As observações 2 e 3 surpreenderam os pesquisadores e os levaram a supor que o responsável pelo espalhamento dos raios deve ter carga positiva e que, em virtude da observação número 1, esse responsável era muito menor que o das partículas alfa..
O próprio Rutherford disse sobre isso que foi "... como se você disparasse um projétil naval de 15 polegadas contra uma folha de papel e o projétil ricocheteasse e acertasse você." Isso definitivamente não poderia ser explicado pelo modelo Thompson.
Analisando seus resultados do ponto de vista clássico, Rutherford descobriu a existência do núcleo atômico, onde se concentrava a carga positiva do átomo, o que lhe conferia sua neutralidade..
Rutherford continuou seus experimentos de espalhamento. Em 1918, o novo alvo para as partículas alfa eram os átomos de nitrogênio..
Desse modo, ele detectou núcleos de hidrogênio e soube imediatamente que o único lugar de onde poderiam vir esses núcleos era o próprio nitrogênio. Como foi possível que os núcleos de hidrogênio fossem parte do nitrogênio?
Rutherford então sugeriu que o núcleo do hidrogênio, um elemento já atribuído ao número atômico 1, deve ser uma partícula fundamental. A chamo próton, Palavra grega para designar Primeiro. Assim, as descobertas do núcleo atômico e do próton devem-se a este brilhante neozelandês.
Postulados do modelo atômico de Rutherford
O novo modelo era muito diferente do Thompson. Estes eram seus postulados:
- O átomo contém um núcleo carregado positivamente, que apesar de ser muito pequeno, contém quase toda a massa do átomo.
- Os elétrons orbitam o núcleo atômico a grandes distâncias e em órbitas circulares ou elípticas.
- A carga líquida do átomo é zero, uma vez que as cargas dos elétrons compensam a carga positiva presente no núcleo..
Os cálculos de Rutherford apontaram para um núcleo de forma esférica e um raio tão pequeno quanto 10-quinze m, o valor do raio atômico sendo cerca de 100.000 vezes maior, uma vez que os núcleos estão relativamente distantes: da ordem de 10-10 m.

Isso explica por que a maioria das partículas alfa passou pela folha suavemente ou teve pouca ou nenhuma deflexão..
Visto na escala dos objetos do cotidiano, o átomo de Rutherford seria composto de um núcleo do tamanho de uma bola de beisebol, enquanto o raio atômico seria de cerca de 8 km. Portanto, o átomo pode ser considerado quase tudo como espaço vazio..
Graças à sua semelhança com um sistema solar em miniatura, tornou-se conhecido como o "modelo planetário do átomo". A força de atração eletrostática entre o núcleo e os elétrons seria análoga à atração gravitacional entre o sol e os planetas..
Limitações
No entanto, houve certas discordâncias em relação a alguns fatos observados:
- Se a ideia de que o elétron orbita em torno do núcleo for aceita, acontece que o elétron deve emitir radiação continuamente até colidir com o núcleo, com a conseqüente destruição do átomo em menos de um segundo. Isso, felizmente, não é o que realmente acontece.
- Além disso, em certas ocasiões o átomo emite certas frequências de radiação eletromagnética quando há transições entre um estado de energia superior para outro com energia inferior, e apenas essas frequências, não outras. Como explicar o fato de que a energia é quantizada?
Apesar dessas limitações e do fato de que hoje existem modelos muito mais sofisticados em linha com os fatos observados, o modelo atômico de Rutherford ainda é útil para o aluno ter uma primeira abordagem bem-sucedida do átomo e suas partículas constituintes..
Nesse modelo de átomo, não aparece o nêutron, outro constituinte do núcleo, que só foi descoberto em 1932.
Pouco depois de Rutherford propor seu modelo planetário, em 1913 o físico dinamarquês Niels Bohr o modificaria para explicar por que o átomo não foi destruído e ainda estamos aqui para contar essa história..
Artigos de interesse
Modelo atômico de Schrödinger.
Modelo Atomic de Broglie.
Chadwick Atomic Model.
Modelo atômico de Heisenberg.
Modelo atômico de Perrin.
Modelo atômico de Thomson.
Modelo atômico de Dirac Jordan.
Modelo atômico de Demócrito.
Modelo atômico de Bohr.
Modelo atômico Dalton.
Referências
- Rex, A. 2011. Fundamentos de Física. Pearson. 618-621.
- Zapata, F. 2007. Notas de aula para a cadeira de Radiobiologia e Proteção Radiológica. Escola de Saúde Pública da Universidade Central da Venezuela.



Ainda sem comentários