
Características do modelo atômico de Schrödinger, postulados

O Modelo atômico de Schrödinger foi desenvolvido por Erwin Schrödinger em 1926. Esta proposta é conhecida como o modelo da mecânica quântica do átomo e descreve o comportamento de onda do elétron..

Schrödinger sugeriu que o movimento dos elétrons no átomo correspondia à dualidade onda-partícula e, conseqüentemente, os elétrons poderiam se mover ao redor do núcleo como ondas estacionárias..
Schrödinger, que recebeu o Prêmio Nobel em 1933 por suas contribuições à teoria atômica, desenvolveu a equação do mesmo nome para calcular a probabilidade de um elétron estar em uma posição específica.
Índice do artigo
- 1 Características do modelo atômico de Schrödinger
- 2 experimentos
- 2.1 Experiência de Young: a primeira demonstração da dualidade onda-partícula
- 2.2 A equação de Schrödinger
- 3 postulados
- 4 artigos de interesse
- 5 referências
Características do modelo atômico de Schrödinger
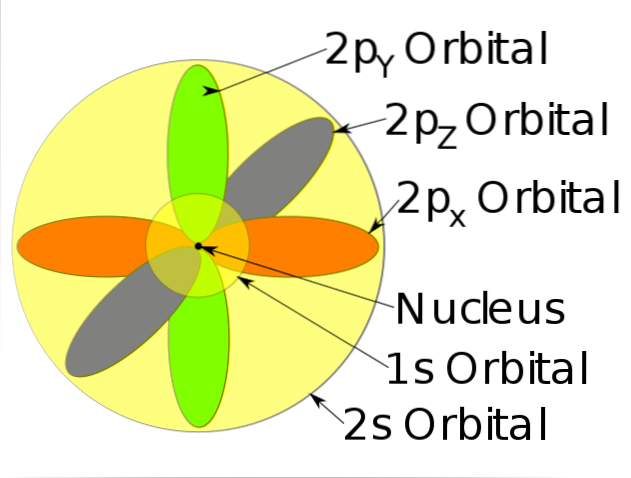
-Descreva o movimento dos elétrons como ondas estacionárias.
-Os elétrons se movem constantemente, ou seja, eles não têm uma posição fixa ou definida dentro do átomo.
-Este modelo não prevê a localização do elétron, nem descreve o caminho que ele segue dentro do átomo. Basta estabelecer uma zona de probabilidade para localizar o elétron.
-Essas áreas de probabilidade são chamadas de orbitais atômicos. Os orbitais descrevem um movimento translacional em torno do núcleo do átomo.
-Esses orbitais atômicos têm diferentes níveis e subníveis de energia e podem ser definidos entre nuvens de elétrons.
-O modelo não contempla a estabilidade do núcleo, apenas se refere a explicar a mecânica quântica associada ao movimento dos elétrons dentro do átomo..

Experimentar
O modelo atômico de Schrödinger é baseado na hipótese de Broglie, bem como nos modelos atômicos anteriores de Bohr e Sommerfeld..
Broglie propôs que, assim como as ondas têm propriedades de partículas, as partículas têm propriedades de ondas, tendo um comprimento de onda associado. Algo que gerou muita expectativa na época, sendo o próprio Albert Einstein endossador de sua teoria.
No entanto, a teoria de de Broglie tinha uma deficiência, que era que o significado da ideia em si não era bem compreendido: um elétron pode ser uma onda, mas de quê? É então que a figura de Schrödinger aparece para dar uma resposta.
Para fazer isso, o físico austríaco confiou na experiência de Young e, com base em suas próprias observações, desenvolveu a expressão matemática que leva seu nome.
Aqui estão as bases científicas deste modelo atômico:
Experiência de Young: a primeira demonstração da dualidade onda-partícula
A hipótese de de Broglie sobre a natureza ondulatória e corpuscular da matéria pode ser demonstrada usando o experimento de Young, também conhecido como experimento de dupla fenda..
O cientista inglês Thomas Young lançou as bases para o modelo atômico de Schrödinger quando, em 1801, realizou o experimento para verificar a natureza ondulatória da luz..
Durante sua experimentação, Young dividiu a emissão de um feixe de luz que passa por um pequeno orifício em uma câmara de observação. Essa divisão é realizada por meio de uma placa de 0,2 milímetros, localizada paralelamente à viga..
O desenho do experimento foi feito de forma que o feixe de luz fosse mais largo que o cartão, assim, ao colocar o cartão na horizontal, o feixe foi dividido em duas partes aproximadamente iguais. A saída dos feixes de luz era dirigida por um espelho.
Ambos os feixes de luz atingiram uma parede em um quarto escuro. Lá o padrão de interferência entre as duas ondas foi evidenciado, o que demonstrou que a luz poderia se comportar tanto como partícula quanto como onda..
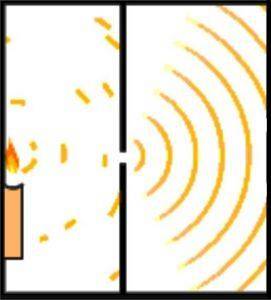
Um século depois, Albert Einsten reforçou a ideia usando os princípios da mecânica quântica..
A equação de Schrödinger
Schrödinger desenvolveu dois modelos matemáticos, diferenciando o que acontece dependendo se o estado quântico muda com o tempo ou não..
Para a análise atômica, Schrödinger publicou a equação de Schrödinger independente do tempo no final de 1926, que se baseia no fato de que as funções de onda se comportam como ondas estacionárias.
Isso implica que a onda não se move, seus nós, ou seja, seus pontos de equilíbrio, servem como um pivô para que o resto da estrutura se mova em torno deles, descrevendo uma frequência e amplitude específicas..
Schrödinger definiu as ondas que descrevem os elétrons como estados estacionários ou orbitais, e estão associadas, por sua vez, a diferentes níveis de energia..
A equação de Schrödinger independente do tempo é a seguinte:
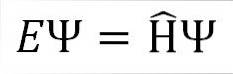
Onde:
E: constante de proporcionalidade.
Ψ: função de onda do sistema quântico.
Η ̂: Operador hamiltoniano.
A equação de Schrödinger independente do tempo é usada quando o observável que representa a energia total do sistema, conhecido como operador hamiltoniano, não depende do tempo. No entanto, a função que descreve o movimento total da onda sempre dependerá do tempo..
A equação de Schrödinger indica que se temos uma função de onda Ψ, e o operador hamiltoniano atua sobre ela, a constante de proporcionalidade E representa a energia total do sistema quântico em um de seus estados estacionários.
Aplicado ao modelo atômico de Schrödinger, se o elétron se move em um espaço definido, existem valores de energia discretos, e se o elétron se move livremente no espaço, existem intervalos de energia contínuos..
Do ponto de vista matemático, existem várias soluções para a equação de Schrödinger, cada solução implica um valor diferente para a constante de proporcionalidade E.
De acordo com o princípio da incerteza de Heisenberg, não é possível estimar a posição e a energia de um elétron. Consequentemente, os cientistas reconhecem que a estimativa da localização do elétron dentro do átomo é imprecisa..
Postulados
Os postulados do modelo atômico de Schrödinger são os seguintes:
-Os elétrons se comportam como ondas estacionárias que são distribuídas no espaço de acordo com a função de onda Ψ.
-Os elétrons se movem dentro do átomo em orbitais. Essas são áreas onde a probabilidade de encontrar um elétron é consideravelmente maior. A referida probabilidade é proporcional ao quadrado da função de onda Ψdois.
A configuração eletrônica do modelo atômico de Schrödinguer explica as propriedades periódicas dos átomos e as ligações que eles formam..
No entanto, o modelo atômico de Schrödinger não considera o spin dos elétrons, nem considera variações no comportamento dos elétrons rápidos devido a efeitos relativísticos..
Artigos de interesse
Modelo Atomic de Broglie.
Chadwick Atomic Model.
Modelo atômico de Heisenberg.
Modelo atômico de Perrin.
Modelo atômico de Thomson.
Modelo atômico Dalton.
Modelo atômico de Dirac Jordan.
Modelo atômico de Demócrito.
Modelo atômico de Leucippus.
Modelo atômico de Bohr.
Modelo atômico de Sommerfeld.
Modelo atômico atual.
Referências
- Modelo atômico de Schrodinger (2015). Recuperado de: quimicas.net
- O modelo da mecânica quântica do átomo recuperado de: en.khanacademy.org
- Equação de onda de Schrödinger (s.f.). Universidade Jaime I. Castellón, Espanha. Recuperado de: uji.es
- Teoria atômica moderna: modelos (2007). © ABCTE. Recuperado de: abcte.org
- Modelo Atômico de Schrodinger (s.f.). Recuperado de: erwinschrodingerbiography.weebly.com
- Wikipedia, The Free Encyclopedia (2018). Equação de Schrödinger. Recuperado de: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2017). Experiência de Young. Recuperado de: es.wikipedia.org



Ainda sem comentários