
Estrutura, propriedades e usos do nitrato de cálcio (Ca (NO3) 2)

O nitrato de cálcio é um sal inorgânico terciário cuja fórmula química é Ca (NO3)dois. Por sua fórmula sabe-se que seu sólido é composto por íons de Cadois+ e não3- em uma proporção de 1: 2. Portanto, é um composto de natureza puramente iônica..
Uma de suas propriedades é o seu caráter oxidante, devido ao ânion nitrato. Não é combustível, ou seja, não queima em altas temperaturas. Por ser incombustível, representa um sólido seguro para manusear sem muitos cuidados; no entanto, pode acelerar a ignição de materiais combustíveis.

Sua aparência consiste em um sólido granular, de cor branca ou cinza claro (imagem superior). Pode ser anidro ou tetra-hidratado, Ca (NO3)dois4hdoisO. É muito solúvel em água, metanol e acetona.
O nitrato de cálcio tem sido amplamente utilizado como fertilizante, pois viaja facilmente em solo úmido e é rapidamente absorvido pelas raízes das plantas. Fornece dois elementos importantes para a nutrição e o crescimento das plantas: nitrogênio e cálcio.
O nitrogênio é um dos três elementos essenciais para o desenvolvimento das plantas (N, P e K), é essencial na síntese de proteínas. Enquanto isso, o cálcio é necessário para manter a estrutura da parede celular da planta. Por esta razão Ca (NÃO3)dois muito vai para jardins.
Por outro lado, esse sal tem ações tóxicas, principalmente pelo contato direto com a pele e os olhos, bem como pela inalação de sua poeira. Além disso, pode ser decomposto por aquecimento.
Índice do artigo
- 1 Estrutura do nitrato de cálcio
- 2 Propriedades físicas e químicas
- 2.1 Nomes químicos
- 2.2 Fórmula molecular
- 2.3 Peso molecular
- 2.4 Aparência física
- 2,5 ponto de ebulição
- 2.6 Ponto de fusão
- 2.7 Solubilidade em água
- 2.8 Solubilidade em solventes orgânicos
- 2,9 Acidez (pKa)
- 2.10 Densidade
- 2.11 Decomposição
- 2.12 Perfil reativo
- 3 usos
- 3.1 Agricultura
- 3.2 Betão
- 3.3 Esgoto ou tratamento de águas residuais
- 3.4 Fazendo compressas frias
- 3.5 Coagulação de látex
- 3.6 Transferência e armazenamento de calor
- 4 formas de candidatura
- 5 referências
Estrutura do nitrato de cálcio
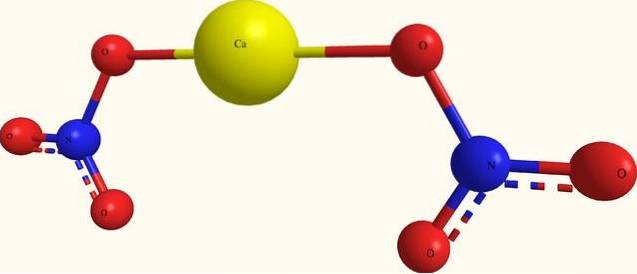
A imagem superior mostra a estrutura do Ca (NO3)dois em um modelo de esferas e barras. Aqui, entretanto, há uma falha: presume-se a existência de ligações covalentes Ca-O, o que contradiz seu caráter iônico. Esclarecendo isso, realmente as interações são do tipo eletrostático.
O cátion Cadois+ envolve-se com dois ânions NO3- de acordo com suas proporções no vidro. Portanto, o nitrogênio predomina na forma de nitrato na estrutura cristalina..
Os íons são agrupados de maneira que estabelecem uma configuração cuja expressão mínima é a célula unitária; que, para o sal anidro, é cúbico. Ou seja, a partir de cubos contendo a proporção de 1: 2 para esses íons, todo o cristal é reproduzido.
Por outro lado, o sal tetra-hidratado, Ca (NO3)dois4hdoisOu, tem quatro moléculas de água para cada conjunto NÃO3- ACdois+ NÃO3-. Isso modifica a estrutura do cristal, deformando-a em uma célula unitária monoclínica..
Portanto, espera-se que os cristais para ambos os sais anidro e tetra-hidratado sejam diferentes; diferenças que podem ser determinadas em suas propriedades físicas, por exemplo, pontos de fusão.
Propriedades físicas e químicas
Nomes químicos
-Nitrato de cálcio
-Dinitrato de cálcio
-Nitrocalcita
-Salitre norueguês e limesaltpetro.
Fórmula molecular
Bico; esquichar3)dois ou CaNdoisOU6
Peso molecular
Anidro 164,088 g / mol e tetra-hidratado 236,15 g / mol. Observe o efeito da água no peso molecular e não pode ser negligenciado ao pesá-la..
Aspecto físico
Sólido ou grânulos brancos ou cinza claro. Cristais brancos cúbicos ou grânulos deliquescentes; ou seja, eles absorvem umidade a ponto de se dissolverem como resultado de sua alta solubilidade.
Ponto de ebulição
A forma anidra se decompõe ao ser aquecida a uma temperatura que impede a determinação de seu ponto de ebulição; enquanto a forma tetra-hidratada do sal tem um ponto de ebulição de 132ºC (270ºF, 405K).
Ponto de fusão
-Forma anidra: 561 ° C a 760 mmHg (1042 ° F, 834 K).
-Forma tetra-hidratada: 42,7 ° C (109 ° F, 316 K).
Isso mostra como as moléculas de água interferem nas interações eletrostáticas entre o Cadois+ e não3- dentro dos cristais; e, conseqüentemente, o sólido derrete a uma temperatura muito mais baixa.
Solubilidade em água
-Forma anidra: 1212 g / L a 20 ºC.
-Forma tetrahidrato: 1290 g / L a 20 ºC.
A água nos cristais dificilmente aumenta a solubilidade do sal.
Solubilidade em solventes orgânicos
-Em etanol, 51,42 g / 100 g a 20 ° C.
-Em metanol, 134 g / 100 g a 10 ° C.
-Em acetona, 168 g / 100 g a 20 ° C.
Acidez (pKa)
6,0
Densidade
2,5 g / cm3 a 25 ºC (tetrahidrato).
Decomposição
Quando o nitrato de cálcio é aquecido até a incandescência, ele se decompõe em óxido de cálcio, óxido de nitrogênio e oxigênio..
Perfil reativo
É um agente fortemente oxidante, mas não é combustível. Acelera a ignição de materiais combustíveis. A divisão do nitrato de cálcio em partículas finas facilita sua explosão quando o composto é exposto a fogo prolongado.
As misturas com ésteres alquílicos tornam-se explosivas ao originar ésteres de nitrato alquílico. A combinação de nitrato de cálcio com fósforo, cloreto de estanho (II) ou outro agente redutor pode reagir de forma explosiva.
Formulários
agricultura
É usado em lavouras como fonte de nitrogênio e cálcio. O nitrato de cálcio é muito solúvel em água e facilmente absorvido pelas raízes das plantas. Além disso, não acidifica os solos porque seus íons não podem ser hidrolisados significativamente..
A mistura com fertilizantes contendo fósforo ou sulfato deve ser evitada para evitar a formação de sais insolúveis. Devido à sua higroscopicidade, deve ser armazenado em um ambiente seco e fresco.
Seu uso tem uma vantagem sobre o uso de nitrato de amônio como fertilizante. Embora este último composto contribua com nitrogênio para as plantas, ele interfere na absorção de cálcio, o que pode levar à deficiência de cálcio nas plantas..
O cálcio contribui para a manutenção da estrutura da parede celular das plantas. Na presença de deficiência de cálcio, os tecidos de crescimento das plantas, como pontas de raízes, folhas jovens e pontas de rebentos, costumam apresentar crescimento distorcido..
Amônia diminuída
O nitrato de cálcio reduz o acúmulo de ácidos graxos voláteis e compostos fenólicos, fitotóxicos que se acumulam devido à decomposição dos resíduos da cultura da soja.
Além disso, existe uma tendência do nitrato de cálcio em diminuir a concentração de amônio no solo, o que aumenta a capacidade tampão do hidrogênio..
Concreto
O nitrato de cálcio é usado para reduzir o tempo de pega do concreto. Isso é produzido pela geração de hidróxido de cálcio, talvez por meio de uma reação de duplo deslocamento..
Além disso, o nitrato de cálcio induz a geração do composto de hidróxido de ferro, cuja ação protetora sobre o concreto reduz sua corrosão. Ou seja, o ferro presente pode reagir com os componentes básicos do concreto, como o próprio hidróxido de cálcio..
O nitrato de cálcio diminui o tempo de pega, bem como a resistência do concreto, ao qual foram adicionadas cinzas vulcânicas. Para estudar o efeito da adição de nitrato de cálcio ao concreto, têm sido utilizadas concentrações crescentes de nitrato de cálcio, entre 2% e 10%..
Observou-se uma maior diminuição no tempo de pega, bem como um aumento na resistência do concreto à medida que a concentração de nitrato de cálcio aumentou até 10%..
Esgoto ou tratamento de águas residuais
O nitrato de cálcio é usado para reduzir os odores do esgoto, reduzindo a geração de sulfeto de hidrogênio. Além disso, a matéria orgânica que gera as condições anaeróbias é consumida, o que dificulta a sobrevivência de muitas espécies biológicas..
Fazendo compressas frias
O nitrato de cálcio tetrahidratado é um composto endotérmico, ou seja, tem a capacidade de absorver o calor do meio ambiente. Isso produz um resfriamento dos corpos que entram em contato com os recipientes que o contêm..
As compressas aumentam sua temperatura, e para regenerá-las basta colocá-las no freezer
Coagulação de látex
O nitrato de cálcio é usado na fase de coagulação do látex. Faz parte da solução de imersão e, ao entrar em contato com a solução contendo o látex, quebra sua estabilização e provoca sua coagulação..
Transferência e armazenamento de calor
A mistura binária de sais de nitrato fundido, incluindo cálcio com outros nitratos, é usada no lugar do óleo térmico em usinas de energia solar para transferência e armazenamento de calor.
Formas de candidatura
-O nitrato de cálcio é aplicado misturado ao solo na concentração de 1,59 kg por 30,48 mdois, com rega adequada. O nitrato de cálcio é solubilizado em água, permitindo sua absorção pelas raízes da planta. Em plantações hidropônicas, ele se dissolve na água em crescimento.
-O nitrato de cálcio é também utilizado na forma de spray para pulverizar as folhas e flores, sendo um tratamento eficaz na prevenção do apodrecimento da flor do tomate, da nódoa de cortiça e do caroço amargo da maçã..
-Uma quantidade de nitrato de cálcio é adicionada à mistura formadora do concreto (cimento, areia, pedras e água) e é determinado o efeito que sua adição tem nas propriedades específicas do concreto; como definir velocidade e força.
-O nitrato de cálcio é adicionado em uma concentração adequada para reduzir os odores de esgoto ou água residual, a um nível que os odores sejam toleráveis para as pessoas.
Referências
- Bonnie L. Grant. (2019). Fertilizante de nitrato de cálcio - O que o nitrato de cálcio faz pelas plantas. Recuperado de: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. e Vyn, T.J. (1990). O uso de nitrato de cálcio para reduzir o acúmulo de fitotoxina durante a decomposição de resíduos corpóreos. Canadian Journal of Soil Science 70 (4): 723-726.
- Ogunbode, E. B. e Hassan, I.O. (2011). Efeito da adição de nitrato de cálcio nas propriedades seletivas de concretos contendo cinzas vulcânicas. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Nitrato de cálcio. Recuperado de: en.wikipedia.org
- Shiqi Dong e col. (2018). Inibição da corrosão do aço por nitrato de cálcio em ambientes de fluido de completação enriquecidos com haleto. Volume 2 de degradação de materiais npj, número do artigo: 32.
- Emaginationz Technologies. (2019). Especificações do nitrato de cálcio. Recuperado de: direct2farmer.com
- PubChem. (2019). Nitrato de cálcio. Recuperado de: pubchem.ncbi.nlm.nih.gov


Ainda sem comentários