
Número atômico
Qual é o número atômico?
O número atômico de um elemento químico indica o número de prótons contidos no núcleo atômico desse elemento. No caso de ser um átomo neutro, então o número atômico coincidirá com o número de elétrons do referido elemento.
Como se sabe, o núcleo atômico consiste em prótons e nêutrons. Os prótons têm carga positiva e seu valor coincide com o valor absoluto da carga negativa do elétron, que é 1,6 x 10-19 coulomb em unidades do Sistema Internacional.
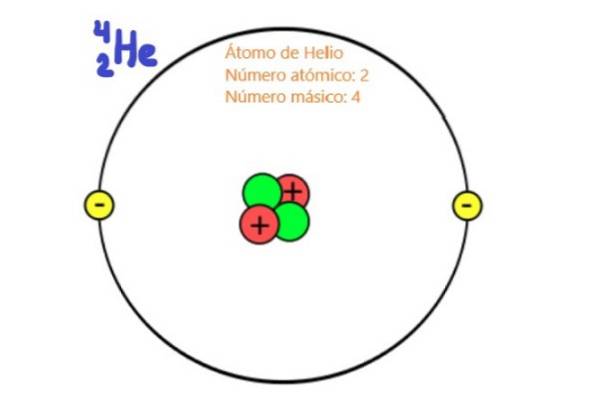
Por serem partículas do núcleo atômico, prótons e nêutrons são conhecidos como núcleons. São essas partículas que praticamente determinam a massa do átomo, já que os núcleos têm cerca de duas mil vezes mais massa do que os elétrons do átomo. Por esta razão, o número de núcleons em um átomo é chamado Número de massa.
No entanto, o número atômico é aquele que determina a afinidade química dos elementos atômicos, pois nos átomos neutros esse número coincide com o número de elétrons..
Representação de número atômico
Na tabela periódica, o símbolo X de um elemento químico é acompanhado no lado esquerdo inferior pelo número Z que representa o número atômico desse elemento, enquanto o número de massa é indicado no canto superior esquerdo do símbolo químico do elemento. PARA.
A figura a seguir mostra essa notação:
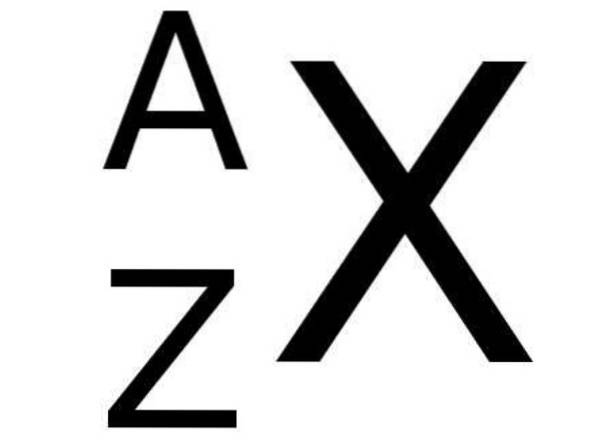
E abaixo, a tabela 1 mostra alguns exemplos de elementos químicos com suas respectivas notações e números atômicos e de massa:
tabela 1
| Elemento | Notação | Número atômico Z | Massa número A |
|---|---|---|---|
| Hidrogênio | 1 1 H | 1 | 1 |
| Carbono | 12 6 C | 6 | 12 |
| Oxigênio | 16 8 OU | 8 | 16 |
| Urânio | 238 92 OU | 92 | 238 |
Número atômico e ordem dos elementos na tabela periódica
A tabela periódica dos elementos químicos permite o arranjo sequencial e em ordem crescente dos elementos, de acordo com o valor de seu número atômico..
Pelo menos 118 deles são conhecidos, começando com hidrogênio até atingir o elemento 118 que é o Oganeson -antes chamado ununoctium-, cujo símbolo químico é Og e seu número de massa é 294.
Os primeiros 10 elementos químicos com ordem crescente em número atômico são muito mais familiares. Por exemplo, temos o mais conhecido:
- Hidrogênio, H
- Helium, He
- Lítio, Li
- Berílio, Be
- Boro, B
- Carbono, C
- Nitrogênio, N
- Oxigênio, O
- Flúor, F
- Neon, Ne

Configuração eletronica
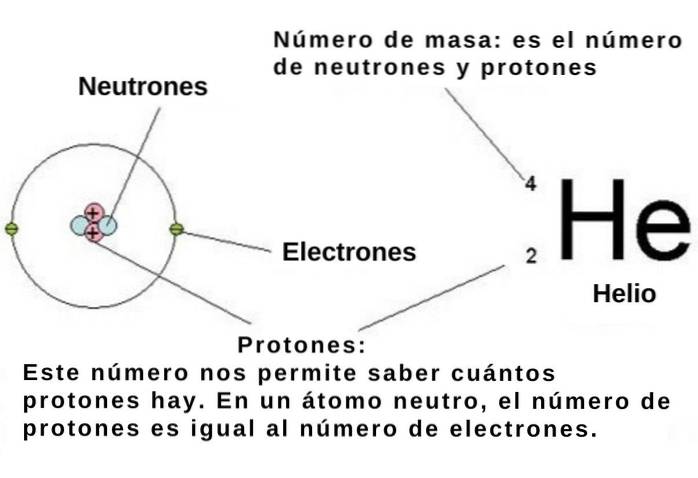
O número atômico indica o número de prótons no núcleo atômico de um elemento químico e cada próton, como dissemos, tem uma carga elementar positiva de 1.602 x 10-19 C.
Se o átomo for neutro, então o número de elétrons elementares carregados negativamente é -1,602 x10-19 C deve ser igual ao número atômico. Assim, sabendo-se a posição numérica de um elemento químico na tabela periódica, seu número de elétrons também é conhecido..
No átomo, esses elétrons ocupam regiões chamadas orbitais, que dependem da energia e do momento angular do elétron. Por sua vez, tanto a energia quanto o momento angular dos elétrons no átomo são quantizados. Isso significa que eles só podem assumir alguns valores discretos.
Agora, os orbitais são povoados com elétrons de menor para maior energia, seguindo certas regras que determinam a configuração eletrônica.
Desse modo, o número de elétrons nos orbitais mais externos ou nos níveis de um átomo estabelece as ligações que ele pode formar com outros átomos para formar moléculas. Este número depende da configuração do elétron e do número atômico.
Números quânticos
A energia de um elétron no átomo é determinada por seu número quântico principal n, que pode assumir valores inteiros 1, 2, 3 ...
O momento angular do elétron no átomo é determinado pelo número quântico secundário eu (letra ele) e seus valores dependem de n.
Por exemplo, para n = 2, o número quântico secundário assume os valores de 0 a n-1, ou seja: 0 e 1. Da mesma forma, para n = 1 que é o nível de energia mais baixo, o número quântico secundário l é apenas assume o valor 0.
Os números quânticos secundários 0, 1, 2, 3 são denotados alternadamente pelas letras s, p, d e f. Os orbitais s são esféricos e os orbitais p são lobulados.
Existem mais dois números quânticos:
- O número quântico magnético ml, que leva os valores de -l a + l passando por zero.
- O número quântico de spin s, que assume apenas valores + ½ e -½ e é uma característica do elétron.
Finalmente, há o princípio de exclusão de Pauli, que afirma que dois elétrons não podem ter todos os quatro números quânticos idênticos. Como consequência deste princípio, um orbital pode ter no máximo dois elétrons com spin oposto.
Diagrama de configuração eletrônica
O diagrama de configuração de elétrons é usado para saber a ordem de preenchimento dos elétrons desde os orbitais de menor energia até os de maior energia, uma vez que o número atômico de um elemento químico é conhecido. A Figura 4 mostra este diagrama:
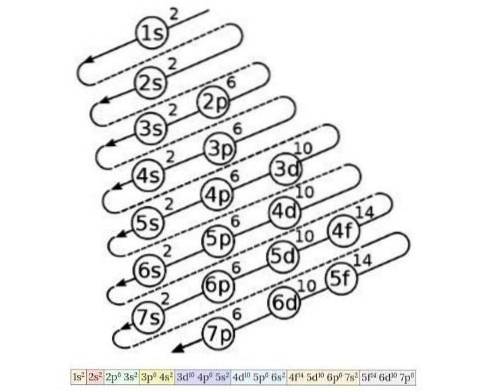
A ideia aí delineada é a seguinte: o primeiro número indica o número quântico principal, depois a letra indica o número quântico secundário e, por fim, o número sobrescrito indica o número máximo de elétrons possíveis naquele orbital..
Exemplo
Configuração eletrônica de carbono e silício
Conforme indicado acima, o carbono possui número atômico 6, o que significa que possui 6 elétrons que são distribuídos da seguinte forma: 1s2 2s2 2p2. Por sua vez, o silício possui número atômico 14 e seus elétrons são distribuídos desta outra forma: 1s2 2s2 2p6 3s2 3p2.
Ambos os elementos estão na mesma coluna da tabela periódica, pois, embora tenham números atômicos diferentes, possuem a mesma configuração eletrônica na tabela periódica. orbital mais externo.
Referências
- Connor, N. What is Nucleon - Structure of Atomic Nucleus - Definition. Recuperado de: periodic-table.org.
- Cúpula dos Povos. Número atômico: o que é, como é representado. Recuperado de: cumbrepuebloscop20.org
- Lifeder. O que é periodicidade química? Recuperado de: lifeder.com
- Wikipedia. Configuração eletronica. Recuperado de: es.wikipedia.com
- Wikipedia. Número atômico. Recuperado de: es.wikipedia.com


Ainda sem comentários