
Numere em massa em que consiste e como obtê-lo (com exemplos)

O Número de massa O número de massa de um átomo é a soma do número de prótons e do número de nêutrons no núcleo. Essas partículas são designadas indistintamente pelo nome de núcleons, portanto, o número de massa representa a quantidade deles.
Seja N o número de nêutrons presentes e Z o número de prótons, se chamarmos A como o número de massa, então:
A = N + Z
Índice do artigo
- 1 Exemplos de números de massa
- 1.1 Hidrogênio
- 1,2 oxigênio
- 1.3 Carbono
- 1.4 Urânio
- 2 Como obter o número de massa?
- 2.1 Notação para átomos
- 3 isótopos
- 3.1 Isótopos de carbono
- 4 exemplos trabalhados
- 4.1 - Exemplo 1
- 4.2 - Exemplo 2
- 5 referências
Exemplos de números de massa
Aqui estão alguns exemplos de números de massa para elementos conhecidos:
Hidrogênio
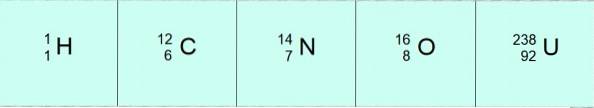
O átomo de hidrogênio mais estável e abundante também é o mais simples: 1 próton e um elétron. Uma vez que o núcleo do hidrogênio não tem nêutrons, é verdade que A = Z = 1.
Oxigênio
Um núcleo de oxigênio tem 8 nêutrons e 8 prótons, portanto, A = 16.
Carbono
A vida na Terra é baseada na química do carbono, um átomo de luz com 6 prótons em seu núcleo mais 6 nêutrons, então A = 6 + 6 = 12.
Urânio
Este elemento, muito mais pesado que os anteriores, é bem conhecido por suas propriedades radioativas. O núcleo de urânio tem 92 prótons e 146 nêutrons. Então, seu número de massa é A = 92 + 146 = 238.
Como obter o número de massa?
Como mencionado antes, o número de massa A de um elemento sempre corresponde à soma do número de prótons e do número de nêutrons que seu núcleo contém. Também é um número inteiro, mas ... existe alguma regra a respeito da relação entre as duas quantidades??
Vejamos: todos os elementos mencionados acima são leves, exceto o urânio. O átomo de hidrogênio é, como dissemos, o mais simples. Não tem nêutrons, pelo menos em sua versão mais abundante, e em oxigênio e carbono, há números iguais de prótons e nêutrons.
Isso também acontece com outros elementos leves, como o nitrogênio, outro gás muito importante para a vida, que possui 7 prótons e 7 nêutrons. No entanto, à medida que o núcleo se torna mais complexo e os átomos mais pesados, o número de nêutrons aumenta em uma taxa diferente..
Ao contrário dos elementos leves, o urânio, com 92 prótons, tem aproximadamente 1 ½ vezes essa quantidade em nêutrons: 1 ½ x 92 = 1,5 x 92 = 138.
Como você pode ver, é bem próximo de 146, a quantidade de nêutrons que possui.
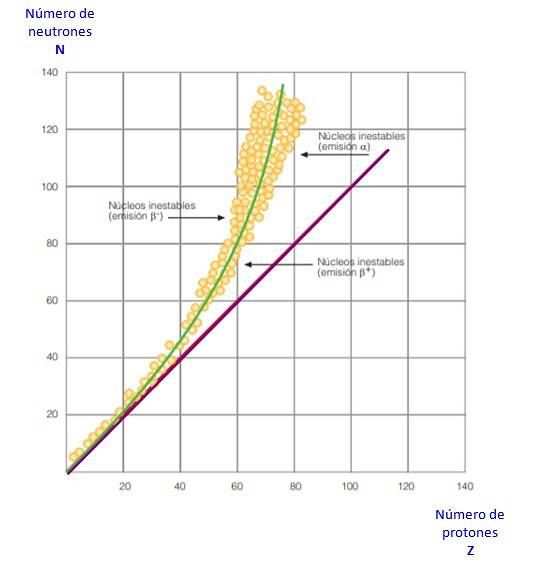
Tudo isso é evidente na curva da figura 2. É um gráfico de N versus Z, conhecido como curva de estabilidade nuclear. Lá você pode ver como os átomos leves têm o mesmo número de prótons que os nêutrons e como a partir de Z = 20 o número de nêutrons aumenta..
Desta forma, o grande átomo torna-se mais estável, pois o excesso de nêutrons reduz a repulsão eletrostática entre os prótons..
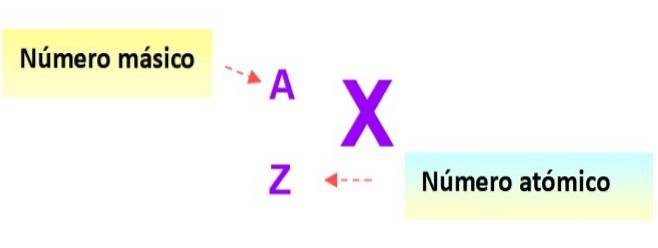
Notação para átomos
Uma notação muito útil que descreve rapidamente o tipo de átomo é a seguinte: o símbolo do elemento e os respectivos números atômicos e de massa são escritos conforme mostrado abaixo neste diagrama:
Nesta notação, os átomos nos exemplos anteriores seriam:
Às vezes, outra notação mais confortável é usada, na qual apenas o símbolo do elemento e o número de massa são usados para denotar o átomo, omitindo o número atômico. Desta forma, o 12 6C é simplesmente escrito como carbono-12, o 16 8Ou seria oxigênio-16 e assim por diante para qualquer elemento.
Isótopos
O número de prótons em um núcleo determina a natureza do elemento. Por exemplo, cada átomo cujo núcleo contém 29 prótons é um átomo de cobre, não importa o quê..
Suponha que um átomo de cobre perca um elétron por qualquer motivo, ainda é cobre. No entanto, agora é um átomo ionizado.
É mais difícil para um núcleo atômico ganhar ou perder um próton, mas na natureza isso pode ocorrer. Por exemplo, dentro das estrelas, os elementos mais pesados são continuamente formados a partir de elementos leves, uma vez que o núcleo estelar se comporta como um reator de fusão..
E bem aqui na Terra existe o fenômeno de decaimento radioativo, em que alguns átomos instáveis expelem núcleons e emitem energia, transformando-se em outros elementos.
Finalmente, existe a possibilidade de que um átomo de um determinado elemento tenha um número de massa diferente, neste caso é um isótopo.
Um bom exemplo é o conhecido carbono-14 ou radiocarbono, que é usado para datar objetos arqueológicos e como um traçador bioquímico. É o mesmo carbono, com propriedades químicas idênticas, mas com dois nêutrons extras.
O carbono-14 é menos abundante que o carbono-12, o isótopo estável, e também é radioativo. Isso significa que com o tempo ele decai emitindo energia e partículas até se tornar um elemento estável, que no seu caso é o nitrogênio..
Isótopos de carbono
O carbono existe na natureza como uma mistura de vários isótopos, dos quais o mais abundante é o já mencionado 12 6C ou carbono-12. E além do carbono-14 existe 13 6C com um nêutron adicional.
Isso é comum na natureza, por exemplo, 10 isótopos estáveis são conhecidos de estanho. Por outro lado, de berílio e sódio, apenas um único isótopo é conhecido.
Cada isótopo, natural ou artificial, tem uma taxa de transformação diferente. Da mesma forma, é possível criar isótopos artificiais em laboratório, que geralmente são instáveis e decaem radioativamente em um período muito curto de frações de segundo, enquanto outros demoram muito mais, desde que a idade da Terra ou mais ..
Tabela de isótopos naturais de carbono
| Isótopos de carbono | Número atômico Z | Massa número A | Abundância% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98,89 |
| 13 6 C | 6 | 13 | 1,11 |
| 14 6 C | 6 | 14 | Traços |
Exemplos trabalhados
- Exemplo 1
Qual é a diferença entre 13 7 N e 14 7 N?
Responder
Ambos são átomos de nitrogênio, pois seu número atômico é 7. No entanto, um dos isótopos, aquele com A = 13, tem um nêutron a menos, enquanto o 14 7 N é o isótopo mais abundante.
- Exemplo 2
Quantos nêutrons existem no núcleo de um átomo de mercúrio, denotado como 201 80 Hg?
Responder
Uma vez que A = 201 e Z = 80, e também sabendo que:
A = Z + N
N = A - Z = 201 - 80 = 121
E conclui-se que o átomo de mercúrio tem 121 nêutrons.
Referências
- Connor, N. What is Nucleon - Structure of Atomic Nucleus - Definition. Recuperado de: periodic-table.org.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Sears, Zemansky. 2016. Física Universitária com Física Moderna. 14º. Ed. Volume 2.
- Tippens, P. 2011. Physics: Concepts and Applications. 7ª Edição. Colina Mcgraw.
- Wikipedia. Número de massa. Recuperado de: en.wikipedia.org.



Ainda sem comentários