
Para que serve a Tabela Periódica? 7 usos importantes

O tabela periódica Serve para mostrar as relações entre os diferentes elementos; Também pode ser usado para prever as propriedades de novos elementos ainda descobertos ou ainda não sintetizados..
Fornece informações e dados sobre os grupos, elementos, massa atômica, energia de ionização, configuração eletrônica, número atômico, eletronegatividade e estados de oxidação. A tabela periódica também fornece uma estrutura útil para analisar o comportamento químico; É amplamente utilizado na área da química e em muitas outras ciências.
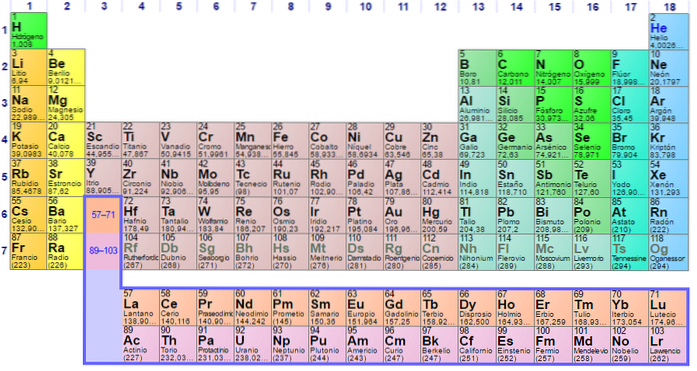
Foi construído em 1869 pelo cientista russo Dmitri Ivanovich Mendeleev para visualizar as diferentes relações entre os vários elementos químicos.
A tabela periódica é ordenada por seu número atômico, configurações eletrônicas e propriedades químicas recorrentes. Também é ordenado de forma que os itens com comportamentos semelhantes fiquem na mesma coluna.
A mesa possui quatro blocos retangulares com propriedades químicas semelhantes. Geralmente, os elementos localizados no lado esquerdo de uma linha são metais, e os não-metais estão localizados no lado direito.
Os elementos estão localizados na tabela periódica com base em sua estrutura atômica. Cada linha e cada coluna têm características especiais.
Todas as linhas da tabela são lidas da esquerda para a direita e cada linha é chamada de ponto. Cada coluna da tabela é chamada de grupo. Cada grupo na tabela tem o mesmo número de elétrons.
É fácil encontrar o número de elétrons na camada externa de cada elemento da tabela. O grupo um tem um elétron, o grupo dois tem dois e assim por diante.
Uma boa tabela periódica é uma ótima ferramenta para a solução de problemas em química. As tabelas periódicas podem ser encontradas na web ou podem ser impressas.
Usos da tabela periódica para que serve?
Conheça o símbolo do elemento químico
Os símbolos são abreviações para o nome do item. Em muitos casos, a abreviatura vem do nome original em latim.
Cada símbolo possui uma ou duas letras como abreviatura. Normalmente, o símbolo é uma abreviatura do nome do elemento, mas alguns símbolos referem-se aos nomes antigos dos elementos.
Um exemplo desse caso é prata; seu símbolo é Ag, que se refere ao seu antigo nome que era argentum.
Conheça o número atômico do elemento
Este é o número de prótons que um átomo deste elemento contém. O número de prótons é o fator decisivo quando se trata de distinguir um elemento de outro. A variação no número de elétrons ou nêutrons não altera o tipo de elemento.
Mudanças no número de elétrons produzem íons, enquanto mudanças no número de nêutrons produzem isótopos. A tabela periódica moderna é organizada em ordem crescente de número atômico.
Identifique o que significam os períodos e grupos da tabela periódica
As linhas horizontais são chamadas de períodos. Cada período indica o nível mais alto de energia que cada um dos elétrons daquele elemento ocupa em seu estado de base..
As colunas verticais são chamadas de grupos. Cada elemento em um grupo tem o mesmo número de elétrons de valência e eles normalmente se comportam de maneira semelhante quando relacionados a outros elementos..
As duas últimas filas, os lantanídeos e os actinídeos, pertencem ao grupo 3B e são listadas separadamente..
Conheça o nome do elemento
Muitas tabelas periódicas também incluem o nome completo do item. Isso é útil quando se trata de conhecer um elemento, pois nem sempre se lembra dos símbolos de todos os elementos.
Familiarize-se com a massa atômica do elemento em unidades de massa atômica
Este número se refere à massa média pesada dos isótopos de um elemento químico. A tabela periódica original de Mendeleev foi organizada de forma que os elementos fossem exibidos em ordem crescente de massa ou peso atômico..
Identifique os tipos de elementos
Muitas tabelas periódicas identificam diferentes tipos de elementos usando cores diferentes para diferentes tipos de elementos.
Esses tipos incluem metais alcalinos, metais básicos, metais de transição, não metais, gases nobres, alógenos, alcalino-terrosos, semimetais, actinídeos e lantanídeos..
Mostre as diferentes tendências (periodicidade)
A tabela periódica é organizada para mostrar os diferentes tipos de tendência (periodicidade). Entre elas:
- O raio atômico, que é a metade da distância entre os centros de dois átomos que mal se tocam:
- Ele aumenta à medida que você se move do topo para o fundo da tabela periódica.
- Ele desce à medida que se move da esquerda para a direita na tabela periódica.
- Energia de ionização, que é a energia necessária para remover um elétron do átomo.
- Ele desce à medida que sobe e desce na tabela periódica.
- Aumenta conforme você se move da esquerda para a direita na tabela periódica.
- Eletronegatividade, que mede a capacidade de formar uma ligação química.
- Ele desce conforme se move para cima e para baixo.
- Aumenta conforme você se move da esquerda para a direita.
- Afinidade de elétron, que se refere à capacidade do elemento de aceitar um elétron.
A afinidade eletrônica pode ser prevista com base nos grupos dos elementos. Gases nobres, como argônio e néon, têm afinidade eletrônica próxima de zero e tendem a não aceitar elétrons..
Halogênios, como cloro e iodo, têm alta afinidade eletrônica. A maioria dos outros grupos de elementos tem afinidades eletrônicas mais baixas do que a dos alógenos, mas muito mais altas do que a dos gases nobres..
Referências
- Qual é o propósito da tabela periódica? Recuperado de reference.com
- Como usar uma tabela periódica (2017) Recuperado de thinkingco.com
- Como são organizados os elementos da tabela periódica? Recuperado de reference.com
- Tabela periódica. Recuperado de wikipeda.org
- Por que a tabela periódica é útil. Recuperado de reference.com
Ainda sem comentários