
Estrutura, propriedades, usos, produção do peróxido de hidrogênio (H2O2)
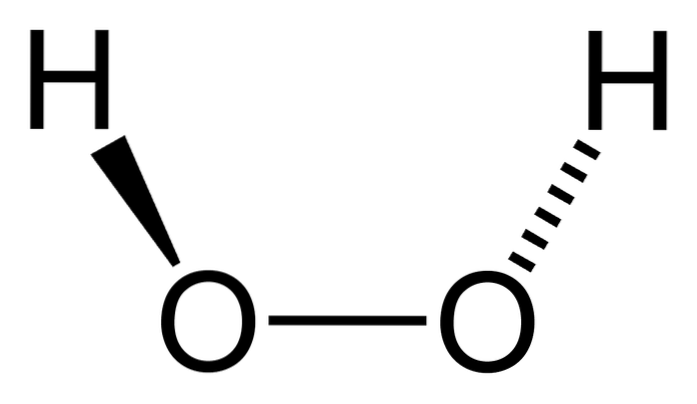
O peróxido de hidrogênio é um composto inorgânico cuja fórmula química é HdoisOUdois. De todos, é o peróxido mais simples dessa família de compostos químicos. Sua fórmula estrutural é H-O-O-H, sendo esta ponte oxigenada interna característica para todos os peróxidos.
Em 1818, o HdoisOUdois Foi identificado por Louies Jacques Thénard, que preparou um composto químico que na época chamou de peróxido de hidrogênio. É um composto instável, que se decompõe quando exposto à luz, calor e alguns metais.
É um composto muito útil que é usado na desinfecção de pequenas feridas, clareamento capilar, tratamento de água, etc. Embora possa ter ações prejudiciais ao homem, é encontrada em todas as células eucarióticas dos seres vivos, onde desempenha diversas funções benéficas..
O peróxido de hidrogênio produz a oxidação de substâncias tóxicas como fenóis, etanol, formaldeído, etc., produtos que são eliminados pelo fígado e rins. Além disso, contribui para a destruição de bactérias fagocitadas por leucócitos neutrofílicos e macrófagos..
Índice do artigo
- 1 Estrutura
- 1.1 Molécula
- 1.2 Rotações
- 1.3 Interações intermoleculares
- 2 propriedades
- 2.1 Nomes
- 2,2 massa molar
- 2.3 Aparência física
- 2.4 Odor
- 2,5 Sabor
- 2.6 Densidade
- 2.7 Ponto de fusão
- 2.8 Ponto de ebulição
- 2.9 Solubilidade em água
- 2.10 Solubilidade
- 2.11 Coeficiente de partição octanol / água
- 2.12 Pressão de vapor
- 2.13 Constante de dissociação
- 2,14 pH
- 2,15 Índice de refração (nD)
- 2,16 Viscosidade
- 2.17 Capacidade de calor
- 2,18 Calor de vaporização
- 2,19 Estabilidade
- 2.20 Corrosão
- 2.21 Decomposição
- 2.22 Tensão superficial
- 2.23 Reatividade
- 3 usos
- 3.1 Clareamento
- 3.2 Desinfetante
- 3.3 Detergente
- 3.4 Aplicação cosmética
- 3.5 Propelente
- 4 Obtendo
- 4.1 Hidrogenação
- 4.2 Filtração
- 4.3 oxidação
- 4.4 Extração e purificação
- 5 riscos
- 6 referências
Estrutura
Molécula
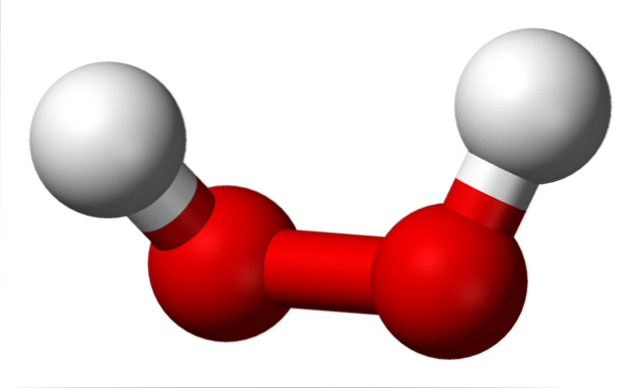
A imagem superior mostra a estrutura da molécula HdoisOUdois (H-O-O-H), com as esferas vermelhas correspondendo aos átomos de oxigênio e as brancas aos átomos de hidrogênio. Observe que a molécula não é plana e que os átomos de H não são eclipsados no espaço (um na frente do outro).
Curiosamente, para o HdoisOUdois É difícil para ele girar sua ligação O-O simples central, de modo que as posições desses H não podem ser trocadas; um não vai descer enquanto o outro sobe.
Por quê? Porque nos dois átomos de oxigênio existem dois pares de elétrons livres, o que dá um total de oito elétrons muito próximos que se repelem devido às suas cargas negativas..
Rotações
Mesmo assim, a ligação O-O é suscetível a uma ligeira rotação devido às interações com seu ambiente..
Por exemplo, aproximando os dois polegares, com os dedos indicadores estendidos e os outros fechados, como se estivesse desenhando uma quadra, e girando os polegares de forma que um dos dedos indicadores aponte para a frente e o outro para trás, você irá tem uma representação aproximada de HdoisOUdois.
Se um corpo tocar qualquer dedo indicador, os polegares girarão em resposta a essa interação; entretanto, eles retornarão imediatamente à sua posição original devido às repulsões eletrônicas mencionadas acima. Essas rotações, portanto, enquadram os aspectos dinâmicos desta molécula.
Interações intermoleculares
No estado líquido, o HdoisOUdois consegue estabelecer ligações de hidrogênio (HOOH-OdoisHdois), visto que, caso contrário, seu alto ponto de ebulição (150 ºC) em relação à água não seria explicado.
Uma vez que passa para a fase gasosa, as moléculas HdoisOUdois presumivelmente, ele não pode mais formar tais pontes, devido não apenas à maior distância intermolecular, mas também os átomos de hidrogênio seriam os primeiros a se tocar em caso de colisões (isso pode ser visualizado recorrendo novamente ao modelo do dedo).
Já na fase sólida, o ângulo dos planos estabelecido pelo H é de 90º (coloque os dedos indicadores perpendiculares). Agora as ligações de hidrogênio se tornam ainda mais importantes e as moléculas de HdoisOUdois estão dispostos em um cristal de estrutura tetragonal.
Propriedades
sBottle com água oxigenada. Nas farmácias, é obtido com uma concentração de 3% m / v. Fonte: Pixnio.
Nomes
-Peróxido de hidrogênio
-Antioxidante
-Oxidanol
-Ácido peridroxico
-O-hidroxiol
-Água oxigenada
Massa molar
34,0147 g / mol
Aparência física
Líquido azul claro (concentrado) ou incolor. É um pouco mais viscoso e denso que a água. É destilado por segurança a baixas temperaturas e sob pressão reduzida, uma vez que se decompõe por aquecimento de forma explosiva.
Odor
Odor agudo ou de ozônio.
Gosto
Amargo
Densidade
Sólido 1,71 g / cm3
As densidades de suas soluções aquosas dependem de sua concentração; por exemplo, a 27% tem uma densidade de 1,10 g / cm3, enquanto a 50%, 1,13 g / cm3
Ponto de fusão
- 0,43 ºC
Ponto de ebulição
150,2 ° C Este valor foi obtido por extrapolação, pois o peróxido de hidrogênio se decompõe em altas temperaturas..
Solubilidade em água
Miscível ≥ 100 mg / mL a 25 ºC
Solubilidade
É solúvel em éter e álcoois, mas insolúvel em éter de petróleo. Decompõe-se em água e oxigênio em muitos solventes orgânicos.
Coeficiente de partição octanol / água
Log P = - 0,43
Pressão de vapor
5 mmHg a 30 ºC.
Constante de dissociação
pKa = 11,72
pH
As soluções de peróxido de hidrogênio são ligeiramente ácidas. Por exemplo, um de 35% tem um pH de 4,6; mas, concentrando-se em 90%, o pH se torna menos ácido: 5,1.
Índice de refração (nD)
1,4061
Viscosidade
1.245 cPoise a 20 ºC.
Capacidade de calor
1.267 J / gK (gás)
2.619 J / gK (líquido)
Calor da vaporização
1.519 J / gK
Estabilidade
Estável nas condições recomendadas. É ainda estabilizado pela adição de acetanilida e sais de estanho.
Corrosão
Corrosivo
Decomposição
Ele se decompõe quando exposto à luz ou na presença de substâncias oxidantes e redutoras. Também se decompõe com o aquecimento. Quando se decompõe, libera água e oxigênio, sendo favorecido pelo aumento do pH e da temperatura, bem como pela presença da enzima catalase..
Tensão superficial
80,4 dinas / cm a 20 ° C
Reatividade
O HdoisOUdois Ele atua como um agente oxidante em soluções ácidas de ferro ferroso (Fedois+) para ferro férrico (F3+); também oxida o íon sulfito (SO3dois-) para íon sulfato (SO4dois-).
Também pode atuar como redutor na presença de soluções básicas, reduzindo o hipoclorito de sódio (NaOCl) e o permanganato de potássio (KMnO4) com a liberação de oxigênio.
Formulários
Branqueamento
O peróxido de hidrogênio é usado na indústria de papel na celulose e no branqueamento de papel, que consome a maior parte de sua produção anual.
Desinfetante
O peróxido de hidrogênio é um anti-séptico suave para prevenir a infecção de pequenas feridas, arranhões e queimaduras. Também é usado como enxaguatório bucal e para aliviar irritações leves da boca devido à presença de aftas ou gengivite..
Também é usado para desinfetar superfícies, o interior de geladeiras, água e combater o crescimento excessivo de bactérias em sistemas de água e torres de resfriamento. O peróxido de hidrogênio libera radicais livres de oxigênio, que decompõem os poluentes.
Detergente
O peróxido de hidrogênio é usado na fabricação de detergentes para branquear roupas, incluindo o percarbonato de sódio. Este composto é um complexo de carbonato de sódio e peróxido de hidrogênio que, quando dissolvido em água, se separa em seus componentes.
Aplicação cosmética
O peróxido de hidrogênio diluído é usado no clareamento do cabelo, antes da coloração. Também é usado para clarear os dentes, bem como parte de um creme dental caseiro.
Propulsor
O peróxido de hidrogênio é usado como monopropelente ou componente oxidante de um foguete bipropolente. Ele se decompõe liberando oxigênio e água, característica que permitiu seu uso como propelente.
É bombeado para uma célula de reação com a presença de um catalisador que acelera a referida decomposição. Durante isso, um vapor de água em alta temperatura é produzido.
Quando o vapor é expelido por uma fenda, ele produz um impulso. O submarino V-80, construído em 1940, usava oxigênio gerado a partir do peróxido de hidrogênio em suas turbinas; chamado sistema de turbina de Walter.
Obtendo
Inicialmente, o peróxido de hidrogênio foi obtido industrialmente por hidrólise de persulfato de amônio, [(NH4)doisSdoisOU8] ou a eletrólise de bissulfato de amônio, NH4HSO4.
Atualmente, o peróxido de hidrogênio é obtido industrialmente com o uso da antraquinona. O processo é realizado em quatro etapas: hidrogenação, filtração, oxidação, extração e purificação..
Hidrogenação
A alquilantroquinona é hidrogenada passando o gás hidrogênio por um hidrogenador carregado com alumina e uma pequena quantidade do catalisador (paládio). A temperatura é mantida a 45 ºC com agitação permanente.
A alquildroquinona é convertida em alquilanhidroquinona e tetrahidroalquilanhidroquinona, sendo esta última selecionada por sua maior conveniência para os seguintes procedimentos.
Filtração
A solução contendo a antraquinona hidrogenada é filtrada para remover vestígios do catalisador que ela possa conter..
Oxidação
A solução filtrada é oxidada pela passagem de ar através dela, formando peróxido de hidrogênio de baixa pureza..
Extração e purificação
A solução com o peróxido de hidrogênio passa por uma coluna de extração líquido-líquido. A água flui através da coluna, enquanto a solução com o peróxido de hidrogênio é bombeada através dela.
A água chega ao fundo do extrator com uma concentração de peróxido de hidrogênio entre 25 e 35% p / p. Em seguida, é purificado por destilação a vácuo, até uma concentração de peróxido de hidrogênio de 30%. Finalmente estabiliza e armazena.
Riscos
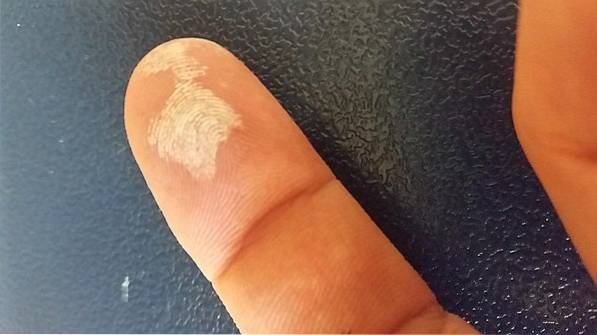
O peróxido de hidrogênio é um agente corrosivo, logo em contato com a pele causa irritação severa, além de clareamento temporário (imagem acima). Também pode causar lesões oculares, coceira, erupção na pele, vermelhidão e bolhas..
A inalação causa irritação no nariz, garganta e pulmões. Enquanto isso, a exposição repetida pode causar bronquite, tosse, catarro e falta de ar. E como se não bastasse, também gera dores de cabeça, tontura, náuseas e vômitos.
A exposição severa ao peróxido de hidrogênio pode causar acúmulo de fluido nos pulmões, conhecido como edema pulmonar - uma condição séria que requer atenção médica imediata..
A Administração de Segurança e Saúde Ocupacional (OSHA) estabeleceu o máximo permitido para peróxido de hidrogênio de 1 ppm em um ambiente de trabalho em um turno de 8 horas. No entanto, por se tratar de um composto mutagênico, a exposição deve ser mínima..
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Peróxido de hidrogênio. Recuperado de: en.wikipedia.org
- William R. Busing e Henri A. Levy. (2004). Estrutura Cristal e Molecular do Peróxido de Hidrogênio: Um Neutron - Estudo de Difração. doi.org/10.1063/1.1696379
- Centro Nacional de Informações sobre Biotecnologia. (2019). Peróxido de hidrogênio. Banco de dados PubChem. CID = 784. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Os editores da Encyclopaedia Britannica. (27 de novembro de 2018). Peróxido de hidrogênio. Encyclopædia Britannica. Recuperado de: britannica.com
- Departamento de Saúde de Nova Jersey. (2016). Peróxido de hidrogênio. [PDF]. Recuperado de: nj.gov
- Mathews, C. K., Van Holde, K. E., Ahern, K. G. (2002). Bioquímica. Terceira edição. Editora Pearson Addison Wesley
- Web MD. (2019). Peróxido de hidrogênio. Recuperado de: webmd.com



Ainda sem comentários