
Características, funções, componentes dos poros nucleares
O poro nuclear (do grego, poros = passagem ou trânsito) é a "porta" do núcleo que permite a maior parte do transporte entre o nucleoplasma e o citoplasma. O poro nuclear se junta às membranas interna e externa do núcleo para formar canais, que servem para transportar proteínas e RNA.
A palavra poro não reflete a complexidade da estrutura em questão. Por causa disso, é preferível referir-se ao complexo de poro nuclear (CPN), em vez de poro nuclear. O CPN pode sofrer alterações em sua estrutura durante o transporte ou estados do ciclo celular.
Recentemente, descobriu-se que as nucleoporinas, proteínas que compõem o CPN, desempenham um papel importante na regulação da expressão gênica. Assim, quando ocorrem mutações que afetam a função das nucleoporinas, ocorrem patologias em humanos, como doenças autoimunes, cardiomiopatias, infecções virais e câncer..
Índice do artigo
- 1 recursos
- 2 funções
- 2.1 Importação de substâncias
- 2.2 Exportação de substâncias
- 2.3 Transporte de RNA
- 2.4 O complexo de poros nucleares e o controle da expressão gênica
- 2.5 O complexo de poros nucleares e virologia
- 3 componentes
- 4 referências
Caracteristicas
Por tomografia eletrônica determinou-se que o CPN possui espessura de 50 nm, diâmetro externo entre 80 e 120 nm e diâmetro interno de 40 nm. Moléculas grandes, como a subunidade do ribossomo grande (MW 1590 kDa), podem ser exportadas para fora do núcleo por meio do CPN. Estima-se que existam entre 2.000 e 4.000 NPCs por núcleo.
O peso molecular de um CPN individual é de aproximadamente entre 120 e 125 MDa (1 MDa = 106 Da) em vertebrados. Em contraste, o CPN é menor na levedura, na qual é de aproximadamente 60 MDa. Apesar do enorme tamanho do CPN, as nucleoporinas são altamente conservadas em todos os eucariotos.
A translocação através do CPN é um processo rápido, cuja velocidade é de 1000 translocações / segundo. No entanto, o próprio CPN não determina a direção do fluxo de transporte..
Depende do gradiente de RanGTP, que é maior no núcleo do que no citosol. Este gradiente é mantido por um fator de troca de guanina Ran.
Durante o ciclo celular, os CPNs passam por ciclos de montagem e desunião de seus componentes. A montagem ocorre na interface e imediatamente após a mitose.
Características
O ácido ribonucleico (pequeno RNA nuclear, RNA mensageiro, RNA de transferência), proteínas e ribonucleoproteínas (RNPs) devem ser transportados ativamente através do CPN. Isso significa que a energia da hidrólise de ATP e GTP é necessária. Cada molécula é transportada de uma forma específica.
Em geral, as moléculas de RNA são empacotadas com proteínas formando complexos RNP, sendo exportadas dessa forma. Em contraste, as proteínas que são ativamente transportadas para o núcleo devem possuir uma sequência de sinal de localização do núcleo (SLN), possuindo resíduos de aminoácidos carregados positivamente (por exemplo, KKKRK)..
As proteínas que são exportadas para o núcleo devem ter um sinal de exportação de núcleo (NES) rico no aminoácido leucina..
Além de facilitar o transporte entre o núcleo e o citoplasma, os CPNs estão envolvidos na organização da cromatina, na regulação da expressão gênica e no reparo do DNA. As nucleoporinas (Nups) promovem a ativação ou repressão da transcrição, independentemente do estado de proliferação celular.
Na levedura, os Nups são encontrados no CNP do envelope nuclear. Nos metazoários, eles são encontrados no interior. Eles realizam as mesmas funções em todos os eucariotos.
Importação de substâncias
Por meio do CPN ocorre a difusão passiva de pequenas moléculas em ambas as direções e o transporte ativo, a importação de proteínas, a exportação de RNA e ribonucleoproteínas (RNPs) e o transporte bidirecional de moléculas. O último inclui RNA, RNP e proteínas envolvidas na sinalização, biogênese e renovação..
A importação de proteínas para o núcleo ocorre em duas etapas: 1) ligação da proteína ao lado citoplasmático do CPN; 2) Translocação dependente de ATP através do CPN. Este processo requer a hidrólise de ATP e a troca de GTP / GDP entre o núcleo e o citoplasma..
De acordo com um modelo de transporte, o complexo receptor-proteína se move ao longo do canal ligando-se, dissociando-se e reconectando-se às sequências FG repetidas das nucleoporinas. Desta forma, o complexo se move de uma nucleoporina para outra dentro do CPN..
Exportação de substâncias
É semelhante à importação. Ran GTPase impõe direcionalidade no transporte por meio do CNP. Ran é um switch molecular com dois estados conformacionais, dependendo se está ligado a GDP ou GTP.
Duas proteínas reguladoras específicas de Ran desencadeiam a conversão entre os dois estados: 1) proteína ativadora de GTPase citosólica (GAP), que causa a hidrólise de GTP e, portanto, converte Ran-GTP em Ran-GDP; e 2) fator de troca de guanina nuclear (GEF), que promove a troca de GDP por GTP e converte Ran-GDP em Ran-GTP.
O citosol contém principalmente Ran-GDP. O kernel contém principalmente Ran-GTP. Este gradiente das duas formas conformacionais de Ran direciona o transporte na direção apropriada..
A importação do receptor, acoplado à carga, é facilitada pelo acoplamento às repetições FG. Se ele atingir o lado nuclear do CNP, Ran-GTP se junta ao receptor para liberar sua posição. Assim, Ran-GTP cria a direção do processo de importação.
A exportação nuclear é semelhante. No entanto, Ran-GTP no núcleo promove a ligação da carga ao receptor de exportação. Quando o receptor de exportação se move através do poro para o citosol, ele encontra Ran-GAP, que induz a hidrólise de GTP em GDP. Finalmente, o receptor é liberado de seu post e Ran-GDP no citosol..
Transporte de RNA
A exportação de algumas classes de RNA é semelhante à exportação de proteínas. Por exemplo, tRNA e nsRNA (núcleo pequeno) usam o gradiente RanGTP e são transportados através do CPN pela carioferina exportin-t e Crm, respectivamente. A exportação de ribossomos maduros também depende do gradiente de RanGTP.
O MRNA é exportado de uma maneira muito diferente do que as proteínas e outros RNAs. Para sua exportação, o mRNA forma um complexo de mensageiro RNP (mRNP), no qual uma molécula de mRNA é circundada por centenas de moléculas de proteína. Essas proteínas têm a função de processar, capping, splicing e poliadenilação de mRNA.
A célula deve ser capaz de distinguir entre mRNA com mRNA maduro e mRNA com mRNA imaturo. O mRNA, que forma o complexo RPNm, pode adotar topologias que precisam ser remodeladas para o transporte. Antes de o mRNP entrar no CPN, ocorre uma etapa de controle realizada por TRAMP e complexos de proteína de exossomo..
Quando o RNPm maduro é montado, o RPNm é transportado através do canal por um receptor de transporte (Nxf1-Nxt1). Este receptor necessita da hidrólise de ATP (não um gradiente de RanGTP) para estabelecer a direcionalidade de remodelação do mRNP, que alcançará o citoplasma.
O complexo de poros nucleares e o controle da expressão gênica
Alguns estudos indicam que os componentes do CPN podem influenciar a regulação da expressão gênica, controlando a estrutura da cromatina e sua acessibilidade aos fatores de transcrição..
Em eucariotos evoluídos mais recentemente, a heterocromatina está localizada preferencialmente na periferia do núcleo. Esse território é interrompido por canais de eucromatina, que são mantidos pela cesta nuclear do CPN. A associação da cesta nuclear com a eucromatina está relacionada à transcrição do gene.
Por exemplo, a ativação da transcrição no nível do CPN envolve a interação de componentes da cesta nuclear com proteínas, como a histona SAGA acetiltransferase e fatores de exportação de RNA..
Assim, a cesta nuclear é uma plataforma para vários genes de manutenção (serviço de limpeza) altamente transcritos e genes fortemente induzidos por mudanças nas condições ambientais.
O complexo de poros nucleares e virologia
A infecção viral de células eucarióticas depende do CPN. Em cada caso de infecção viral, seu sucesso depende da passagem do DNA, RNA ou RPN pelo CPN para atingir seu objetivo final, que é a replicação do vírus..
O vírus símio 40 (SV40) tem sido um dos modelos mais estudados para investigar o papel do CPN na translocação dentro do núcleo. Isso ocorre porque o SV40 tem um genoma pequeno (5.000 bases).
Foi demonstrado que o transporte do DNA do vírus é facilitado pelas proteínas da capa do vírus, que protegem o vírus até que ele atinja o núcleo..
Componentes (editar)
O CPN está embutido no envelope nuclear e é composto de 500 a 1000 Nups, aproximadamente. Essas proteínas são organizadas em subcomplexos estruturais ou módulos, que interagem entre si..
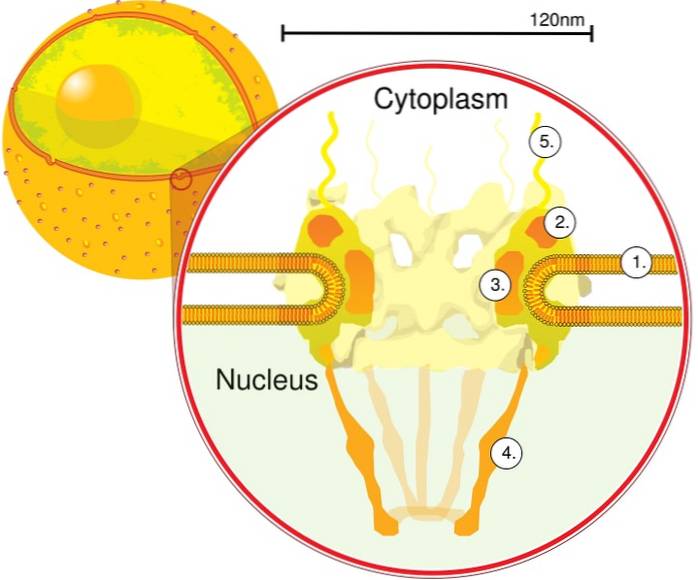
O primeiro módulo é um componente central, ou anel, dentro do poro em forma de ampulheta, que é delimitado por outro anel de 120 nm de diâmetro em ambas as faces, intranuclear e citoplasmático. O segundo módulo são os anéis do núcleo e do citoplasma (120 nm de diâmetro cada) localizados ao redor do componente em forma de ampulheta..
O terceiro módulo é formado por oito filamentos que se projetam do anel de 120 nm para o nucleoplasma e formam uma estrutura em forma de cesta. O quarto módulo é formado pelos filamentos que se projetam para o lado do citoplasma..
O complexo em forma de Y, composto por seis Nups e as proteínas Seh 1 e Sec 13, é o maior e mais bem caracterizado complexo do CNP. Este complexo é a unidade essencial que faz parte do andaime do CPN.
Apesar da baixa similaridade entre as sequências Nups, o andaime CPN é altamente conservado em todos os eucariotos.
Referências
- Beck, M., Hurt, E. 2016. O complexo de poros nucleares: entendendo sua função por meio do insight estrutural. Nature Reviews, Molecular Cell Biology, Doi: 10.1038 / nrm.2016.147.
- Ibarra, A., Hetzer, M.W. 2015. Proteínas de poros nucleares e o controle das funções do genoma. Genes and Development, 29, 337-349.
- Kabachinski, G., Schwartz, T.U. 2015. O complexo de poros nucleares - estrutura e função em um relance. Journal of Cell Science, 128, 423-429.
- Knockenhauer, K.E., Schwartz, T.U. 2016. O complexo de poros nucleares como uma porta flexível e dinâmica. Cell, 164, 1162-1171.
- Ptak, C., Aitchison, J.D., Wozniak, R.W. 2014. O complexo multifuncional de poros nucleares: uma plataforma para controlar a expressão gênica. Opinião Atual da Biologia Celular, DOI: 10.1016 / j.ceb.2014.02.001.
- Stawicki, S.P., Steffen, J. 2017. Republication: the nuclear poro complex - a abrangente review of structure and function. International Journal of Academic Medicine, 3, 51-59.
- Tran, E.J., Wente, S.R. 2006. Complexos de poros nucleares dinâmicos: a vida no limite. Cell, 125, 1041-1053.



Ainda sem comentários