
Fórmulas de processo isobárico, equações, experimentos, exercícios
Em um processo isobárico, a pressão P de um sistema permanece constante. O prefixo "iso" vem do grego e é usado para denotar que algo permanece constante, enquanto "baros", também do grego, significa peso.
Os processos isobáricos são muito típicos tanto em recipientes fechados como em espaços abertos, sendo fáceis de localizar na natureza. Com isso queremos dizer que são possíveis mudanças físicas e químicas na superfície da Terra ou reações químicas em recipientes abertos para a atmosfera..
Alguns exemplos são obtidos aquecendo um balão cheio de ar ao sol, cozinhando, fervendo ou congelando água, vapor gerado em caldeiras ou o processo de levantar um balão de ar quente. Mais tarde daremos uma explicação desses casos.
Índice do artigo
- 1 Fórmula e equações
- 2 experimentos
- 2.1 Processos isobáricos no gás ideal
- 3 exemplos
- 3.1 Água fervente e cozimento
- 3.2 Congele a água
- 3.3 Aquecer um balão cheio de ar ao sol
- 3.4 O balão de ar quente
- 3.5 Caldeiras
- 4 exercícios resolvidos
- 4.1 Exercício 1
- 4.2 Exercício 2
- 5 referências
Fórmula e equações
Vamos derivar uma equação para o processo isobárico assumindo que o sistema em estudo é um gás ideal, um modelo bastante adequado para quase qualquer gás a menos de 3 atmosferas de pressão. As partículas de gás ideais movem-se aleatoriamente, ocupando todo o volume do espaço que as contém, sem interagir umas com as outras..
Se o gás ideal encerrado em um cilindro equipado com um pistão móvel se expandir lentamente, pode-se supor que suas partículas estão em equilíbrio o tempo todo. Em seguida, o gás exerce sobre o pistão da área PARA uma força F de magnitude:
F = p.A
Onde p é a pressão do gás. Esta força exerce trabalho produzindo um deslocamento infinitesimal dx no pistão dado por:
dW = Fdx = pA.dx
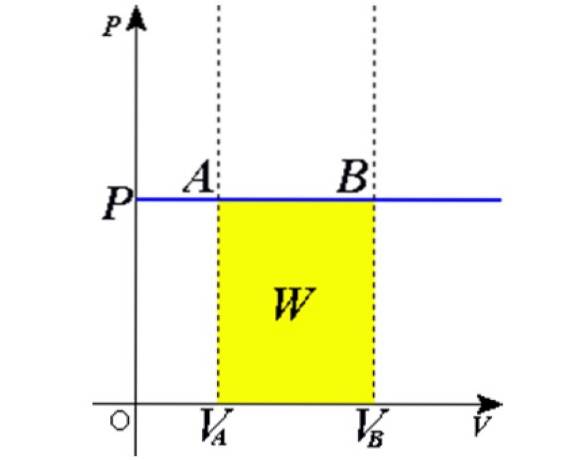
Como o produto Adx é um diferencial de volume dV, então dW = pdV. Resta integrar os dois lados do volume inicial VPARA até o volume final VB para obter o trabalho total feito pelo gás:


Experimentos
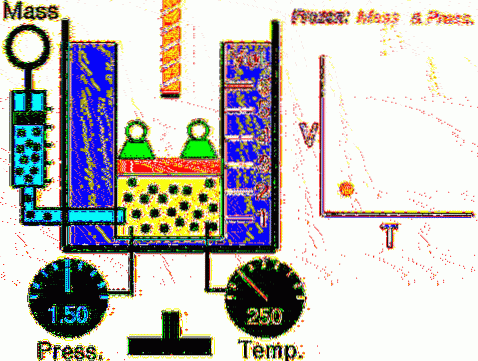
A situação descrita é verificada experimentalmente confinando um gás dentro de um cilindro dotado de um pistão móvel, conforme mostrado nas Figuras 2 e 3. Um peso de massa M é colocado sobre o pistão, cujo peso é direcionado para baixo, enquanto o gás exerce uma força ascendente graças à pressão P produzida no pistão.

Como o pistão pode se mover livremente, o volume que o gás ocupa pode mudar sem problemas, mas a pressão permanece constante. Adicionando a pressão atmosférica Patm, que também exerce uma força para baixo, temos:
Mg - P.A + Patm . A = constante
Portanto: P = (Mg / A) + Patm não varia, a menos que M e, portanto, o peso sejam modificados. Ao adicionar calor ao cilindro, o gás se expandirá aumentando seu volume ou se contrairá ao extrair calor..
Processos isobáricos no gás ideal
A equação de estado do gás ideal relaciona as variáveis de importância: pressão P, volume V e temperatura T:
P.V = n .R.T
Aqui n representa o número de moles e R é a constante de gás ideal (válida para todos os gases), que é calculada multiplicando a constante de Boltzmann pelo número de Avogadro, resultando em:
R = 8,31 J / mol K
Quando a pressão é constante, a equação de estado pode ser escrita como:
V / T = nR / P
Mas nR / P é constante, pois n, R e P são. Assim, quando o sistema vai do estado 1 para o estado 2, surge a seguinte proporção, também conhecida como lei de Charles:
V1/ T1 = Vdois/ Tdois
Substituindo em W = PΔV, o trabalho realizado para ir do estado 1 ao estado 2 é obtido, em termos das constantes e da variação de temperatura, fáceis de medir com um termômetro:
C1 → 2 = nR (Tdois - T1) = nR.ΔT
Por outro lado, a primeira lei da termodinâmica afirma que:
∆U = Q - W
Isso significa que adicionar uma certa quantidade de calor Q ao gás aumenta a energia interna ∆U e aumenta as vibrações de suas moléculas. Desta forma, o gás se expande e funciona movendo o pistão, como já dissemos..
Em um gás ideal monoatômico e a variação da energia interna ∆U, que inclui a energia cinética e a energia potencial de suas moléculas, é:
∆U = (3/2)nR ΔT
Finalmente, combinamos as expressões que temos obtido em uma:
Q = ∆U + W = (3/2)nR ΔT + nR∆T = (5/2) nR ΔT
Alternativamente, Q pode ser reescrito em termos de massa m, a diferença de temperatura e uma nova constante chamada calor específico de gás a pressão constante, abreviado cp, cujas unidades são J / mol K:
Q = m cp ∆T
Exemplos
Nem todos os processos isobáricos são realizados em recipientes fechados. Na verdade, inúmeros processos termodinâmicos de todos os tipos ocorrem à pressão atmosférica, então os processos isobáricos são muito frequentes na natureza. Isso inclui mudanças físicas e químicas na superfície da Terra, reações químicas em vasos abertos para a atmosfera e muito mais..
Para que processos isobáricos ocorram em sistemas fechados, seus limites devem ser flexíveis o suficiente para permitir mudanças no volume sem variação de pressão.
Foi o que aconteceu na experiência do pistão que se movia facilmente conforme o gás se expandia. A mesma coisa acontece encerrando um gás em um balão de festa ou um balão de ar quente.
Aqui temos vários exemplos de processos isobáricos:
Ferva agua e cozinhe
Água fervente para chá ou molhos para cozinhar em recipientes abertos são bons exemplos de processos isobáricos, pois todos ocorrem à pressão atmosférica..
À medida que a água é aquecida, a temperatura e o volume aumentam e se continuar a ser adicionado calor, chega-se finalmente ao ponto de ebulição, no qual ocorre a mudança de fase da água de líquida para vapor. Enquanto isso ocorre, a temperatura também permanece constante em 100ºC..
Congele a água
Por outro lado, o congelamento da água também é um processo isobárico, seja em um lago durante o inverno ou na geladeira doméstica..
Aquecendo um balão cheio de ar ao sol
Outro exemplo de processo isobárico é a alteração do volume de um balão inflado de ar quando fica exposto ao Sol. Logo pela manhã, quando ainda não está muito quente, o balão está com determinado volume..
Com o passar do tempo e com o aumento da temperatura, o balão também se aquece, aumentando seu volume e tudo isso ocorre com pressão constante. O material do balão é um bom exemplo de borda flexível o suficiente para que o ar em seu interior, ao ser aquecido, se expanda sem alterar a pressão.
A experiência também pode ser realizada ajustando o balão não enchido na bica de uma garrafa de vidro cheia de um terço de água, que é aquecida em banho-maria. Assim que a água for aquecida, o balão infla imediatamente, mas deve-se tomar cuidado para não esquentar muito para não explodir..
O balão aerostático
É um navio flutuante sem propulsão, que aproveita as correntes de ar para transportar pessoas e objetos. O balão geralmente é preenchido com ar quente, que, sendo mais frio do que o ar circundante, sobe e se expande fazendo com que o balão suba..
Embora as correntes de ar direcionem o balão, ele possui queimadores que são ativados para aquecer o gás quando se deseja subir ou manter a altitude, e desativam ao descer ou pousar. Tudo isso acontece à pressão atmosférica, assumida constante a uma certa altura não muito longe da superfície..

Caldeiras
O vapor é gerado nas caldeiras aquecendo a água e mantendo a pressão constante. Posteriormente, esse vapor realiza um trabalho aproveitável, por exemplo, gerar eletricidade em termelétricas ou acionar outros mecanismos como locomotivas e bombas d'água..
Exercícios resolvidos
Exercício 1
São 40 litros de gás a uma temperatura de 27 ºC. Encontre o aumento de volume quando o calor é adicionado isobáricamente até atingir 100 ºC.
Solução
A lei de Charles é usada para determinar o volume final, mas atenção: as temperaturas devem ser expressas em Kelvin, bastando adicionar 273 K a cada uma:
27 ºC = 27 + 273 K = 300 K
100 ºC = 100 + 273 K = 373 K
A partir de:
V1/ T1 = Vdois/ Tdois ⇒ Vdois = Tdois(V1/ T1) = 373 ºC (40 L / 300 K) = 49,7 L
Finalmente, o aumento de volume é Vdois - V1 = 49,7 L - 40 L = 9,7 L.
Exercício 2
Fornecido 5,00 x 103 J de energia para um gás ideal para executar 2,00 x 103 J trabalhando em seu ambiente em um processo isobárico. É pedido para encontrar:
a) A mudança na energia interna do gás.
b) A mudança no volume, se agora a energia interna diminuir em 4,50 x 103 J e 7,50 x 10 são ejetados3 J do sistema, considerando pressão constante de 1,01 x 105 Pa.
Solução para
Se utiliza ∆U = Q - W e os valores dados na declaração são substituídos: Q = 5,00 x 103 J e W = 2,00 x 103 J:
=5,00 x 103 J - 2,00 x 103 J = 3,00 x 103 J
Portanto, a energia interna do gás aumenta em 3,00 x 103 J.
Solução b
A mudança de volume é encontrada no trabalho realizado: W = P∆V:
∆U = Q - W = Q - P∆V
A declaração afirma que a energia interna diminui, portanto: ∆U= -4,50 x 103 J. Também nos diz que uma certa quantidade de calor é expelida: Q = -7,50 x 103 J. Em ambos os casos, o sinal negativo representa diminuição e perda, então:
-4,50 x 103 J = -7,50 x 103 J - P∆V
Onde P = 1,01 x 105 Pa. Como todas as unidades estão no Sistema Internacional, procedemos para resolver para a mudança no volume:
∆V = (-4,50 x 103 J +7,50 x 103 J) / (- 1,01 x 105 Pa) = -2,97 x 10-dois m3
Como a variação do volume é negativa, significa que o volume diminuiu, ou seja, o sistema contraiu.
Referências
- Byjou's. Processo isobárico. Recuperado de: byjus.com.
- Cengel, Y. 2012. Thermodynamics. 7ª Edição. Colina Mcgraw.
- Processo xyz. Saiba mais sobre o processo isobárico. Recuperado de: 10proceso.xyz.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9ª Ed. Cengage Learning.
- Wikipedia. Leis do gás. Recuperado de: es.wikipedia.org.


Ainda sem comentários