
Características da Proteinase K, atividade enzimática, aplicações
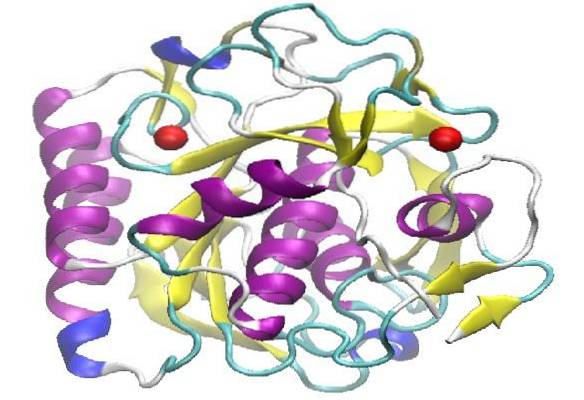
O proteinase K É uma enzima que pertence ao grupo das serina proteases, ou seja, possui um aminoácido serina em seu centro catalítico ativo e tem a função de quebrar ligações peptídicas por hidrólise. Por sua vez, esta enzima pertence à família das proteínas subtilisina (peptidase S8).
A proteinase K tem peso molecular (MW) de 28.900 daltons e foi isolada pela primeira vez em 1974 em extratos do fungo Álbum Engyodontium, anteriormente conhecido como Limber álbum Tritirachium.
Possui alta capacidade proteolítica, demonstrada por ser capaz de degradar a queratina presente nos cabelos. A palavra queratina em inglês é escrita "queratina", por isso tem sido chamada de "proteinase K".
Devido ao seu alto poder de clivar proteínas nativas, essa enzima é útil em várias técnicas de biologia molecular. Usado principalmente para isolar e preparar ácidos nucleicos de alto peso molecular (MW).
A proteinase K atua liberando DNA nuclear, enquanto destrói proteínas e inativa RNases e DNases, ou seja, elimina nucleases em preparações de DNA e RNA..
Por outro lado, constatou-se que a proteinase K pode hidrolisar algumas proteínas nativas desnaturadas, o que tem despertado o interesse de pesquisadores pelo seu uso no estudo de proteínas príon (PrPC)..
No entanto, apesar de sua alta potência proteolítica, existem proteínas que são resistentes à ação da proteinase K. Entre elas estão algumas proteínas anormais chamadas príons (PrPSc), associadas a encefalopatias espongiformes transmissíveis..
Índice do artigo
- 1 Características da proteinase K
- 2 atividade enzimática
- 3 aplicativos
- 4 vantagens da proteinase K
- 5 proteínas resistentes à proteinase K
- 6 referências
Características da proteinase K
A proteinase K tem uma estrutura terciária composta por três camadas, com uma folha β de sete cadeias interposta entre duas camadas de hélices. Por pertencer à família S8 de peptidases, caracteriza-se por possuir em seu sítio ativo uma tríade catalítica, cuja ordem sequencial é (Asp, His e Ser), o que as diferencia de outras famílias de peptidases..
Esta enzima do grupo das serina proteases é caracterizada por hidrolisar as ligações peptídicas próximas ao grupo carboxílico dos aminoácidos alifáticos e aromáticos..
Por outro lado, é capaz de atuar na presença de determinadas substâncias corrosivas, como o dodecil sulfato de sódio (SDS), o Tris-HCL e o EDTA, que auxiliam na desnaturação de proteínas, fazendo com que percam sua estrutura nativa ..
Esta é uma etapa preliminar na preparação de proteínas para a técnica de eletroforese. A faixa de pH em que a proteinase K atua é bastante ampla (2,0 a 12,0), com pH ótimo entre 7,5 a 12,0, e seu ponto isoelétrico é 8,9. Como pode ser visto, é ativo contra uma ampla faixa de pH..
Outra característica que se destaca na proteinase K é sua estabilidade na presença de altas temperaturas (50 - 60 ° C)..
Atividade enzimática
A proteinase K requer a presença do íon cálcio, embora isso não afete sua atividade, se for essencial para manter sua estabilidade.
Para a proteinase K digerir totalmente o substrato, um tempo de contato de aproximadamente 5 minutos a 2 horas é necessário..
Porém, nesse sentido, Daza et al., Compararam a pureza do DNA obtido em vários tempos de exposição com a proteinase K e concluíram que uma incubação prolongada (até 24 h) melhora significativamente a qualidade do DNA..
Já em relação à concentração da enzima proteinase K utilizada nos diferentes protocolos, pode-se dizer que é muito variada.
Pode ser usado desde concentrações muito baixas (5 µg / ml) até concentrações de 500 µg / ml. Mas as concentrações de trabalho mais frequentes variam de 50-100μg / ml, especialmente para digestão de proteínas e inativação de nuclease. Embora para o tratamento de tecidos seja necessária uma concentração de 2 mg / ml.
Formulários
Suas aplicações são muito amplas e podem ser resumidas da seguinte forma:
-É utilizado na digestão de proteínas e extração de DNA por diversos métodos como: salting-out, PK-SDS, brometo de cetil-trimetil amônio (CTAB), acetato de potássio modificado e extração com iodeto de sódio..
-Inativação de nuclease (RNases e DNases).
-Na técnica de hibridização no local (HIS), para auxiliar na liberação de ácido nucléico, além de remover proteínas indesejáveis.
-Modificação de proteína.
-Ao nível da investigação, em vários estudos.
Vantagens da proteinase K
Vários estudos comparativos foram realizados entre as técnicas de extração de DNA que utilizam a Proteinase K, com outras que não a utilizam e todos concluem que há maiores benefícios com o uso da enzima. As vantagens incluem o seguinte:
-DNA de alto peso molecular, alta qualidade e pureza é obtido.
-O DNA extraído é estável por até 3 meses.
O DNA extraído pode ser utilizado nas seguintes técnicas: Southern blot, reação em cadeia da polimerase (PCR), eletroforese, entre outras..
Proteínas resistentes à proteinase K
Várias investigações concluíram que os príons (proteínas PrPSc tóxicas anormais) diferem das proteínas PrPC (nativas) por serem resistentes à ação da proteinase K, enquanto as PrPCs são sensíveis à sua ação.
Outros autores descreveram que na estrutura da PrPSc existem porções sensíveis e outras resistentes à proteinase K. No entanto, ambas as partes são igualmente tóxicas e infecciosas.
Por outro lado, Bastian et al., Em 1987, isolaram 4 proteínas de 28, 30, 66 e 76 kda de uma espécie de Spiroplasma mirum. Todos foram considerados resistentes à ação da proteinase K e também apresentaram reação cruzada com alguns príons..
Sabe-se que esta espécie pode causar cataratas e danos neurológicos significativos e devido aos achados científicos de Bastian, entre outras investigações, tentou-se vincular esse microrganismo às encefalopatias espongiformes transmissíveis..
No entanto, a etiologia desta patologia neurológica degenerativa continua a ser atribuída aos príons hoje..
Nesse sentido, Butler et al., Em 1991, identificaram e caracterizaram uma classe de proteína resistente à proteinase K de 40 kda a partir de duas cepas de Mycoplasma hyorhinis. Este patógeno afeta suínos, infectando seus tecidos, mas neste caso não houve reação cruzada com os príons testados..
Mais pesquisas são necessárias para elucidar muitas incógnitas a esse respeito.
Referências
- Bastian F, Jennings R e Gardner W. 1987. Antisoro para proteína de fibrila associada a scrapie reage de forma cruzada com Spiroplasma mirum proteínas de fibrilas. J. Clin. Microbiol. 25: 2430-2431.
- Daza C, Guillen J, Rey J, Ruiz V. Avaliação de um método de extração e purificação de DNA de tecido muscular fixado com formaldeído de cadáveres não identificados. Revista Med, 2014; 22 (1): 42-49,
- Butler G, Kotani H, Kong L, Frick M, Evancho S, Stanbridge E e McGarrity G. Identificação e caracterização de proteínas resistentes à proteinase K em membros da classe dos molicutos. Infection and Immunity, 1991, 59 (3): 1037-1042
- López M, Rivera M, Viettri M, Lares M, Morocoima A, Herrera L, et al. Comparação de dois protocolos de extração de DNA de Trypanosoma cruzi cultivado em meio axênico. Rev. Peru. Med. Exp. Saúde Pública 2014; 31 (2): 222-227. Disponível em: scielo.org
- Jiménez G, Villalobos M, Jiménez E e Palma W. Determinação da eficácia de cinco protocolos de extração de DNA de material parafinizado para estudos moleculares. Rev Méd Univ Costa Rica. 2007; 1 (1): 10-19.


Ainda sem comentários