
Estrutura, tipos e funções das proteínas G
As Proteínas G ou proteínas de ligação de nucleotídeo guanina, são proteínas associadas à membrana plasmática pertencentes a uma família de proteínas "acopladoras" de sinal que têm funções importantes em muitos processos de transdução de sinal em organismos eucarióticos..
Na literatura, as proteínas G são descritas como interruptores moleculares binários, uma vez que sua atividade biológica é determinada pelas mudanças em sua estrutura dadas pelas espécies de nucleotídeos às quais são capazes de se ligar: nucleotídeos de guanosina (difosfato (GDP) e trifosfato (GTP) ).
Eles são geralmente ativados por receptores de uma família de proteínas conhecidas como receptores acoplados à proteína G (GPCRs).Receptores acoplados à proteína G "), que recebem um sinal inicial externo e o convertem em mudanças conformacionais que desencadeiam a ativação, que posteriormente se traduz na ativação de outra proteína efetora.
Alguns autores consideram que os genes codificadores desta família de proteínas evoluíram por duplicação e divergência de um gene ancestral comum, cujo produto foi cada vez mais refinado e especializado..
Entre a grande variedade de funções celulares que essas proteínas apresentam, estão a translocação de macromoléculas durante a síntese protéica, a transdução de sinais hormonais e estímulos sensoriais, bem como a regulação da proliferação e diferenciação celular..
Duas classes desse tipo de proteína foram descritas: proteínas G pequenas e proteínas G heterotriméricas. A primeira estrutura tridimensional de uma proteína G foi obtida há mais de uma década a partir de uma pequena proteína G conhecida como Ras.
Índice do artigo
- 1 Estrutura
- 2 tipos
- 2.1 Proteínas G pequenas
- 2.2 Proteínas G heterotriméricas
- 3 funções
- 3.1 Como eles funcionam?
- 4 referências
Estrutura
Estruturalmente falando, dois tipos de proteínas G são reconhecidos: as proteínas G pequenas e as proteínas G heterotriméricas, muito mais complexas..
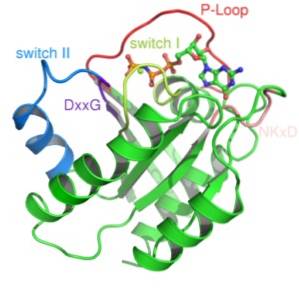
Proteínas G pequenas são constituídas por um único polipeptídeo de cerca de 200 resíduos de aminoácidos e cerca de 20-40 kDa, e em sua estrutura há um domínio catalítico conservado (o domínio G) composto por cinco hélices α, seis folhas dobradas β , e cinco loops polipeptídicos.
As proteínas G heterotriméricas, por outro lado, são proteínas integrais de membrana compostas por três cadeias polipeptídicas, conhecidas como subunidades α, β e γ..
-A subunidade α pesa entre 40 e 52 kDa, tem uma região de ligação do nucleotídeo guanina e tem atividade GTPase para hidrolisar as ligações entre os grupos fosfato do GTP..
As subunidades α de diferentes proteínas G compartilham alguns domínios estruturais, como aqueles para ligação e hidrólise de GTP, mas são muito diferentes em seus locais de ligação para o receptor e proteínas efetoras..
-A subunidade β tem um peso molecular ligeiramente inferior (entre 35 e 36 kDa).
-A subunidade γ, por outro lado, é muito menor e tem um peso molecular aproximado de 8 kDa..
Todas as proteínas G heterotriméricas têm 7 domínios transmembranares e compartilham similaridade de sequência com os domínios β e γ. Esses dois domínios estão tão fortemente associados que são vistos como uma única unidade funcional..
Tipos
Conforme mencionado acima, existem dois tipos de proteínas G: pequenas e heterotriméricas..
Proteínas G pequenas têm papéis no crescimento celular, secreção de proteínas e interação de vesículas intracelulares. Por sua vez, as proteínas G heterotriméricas estão associadas à transdução de sinais de receptores de superfície e também atuam como interruptores que alternam entre dois estados dependendo do nucleotídeo associado..
Proteínas G pequenas
Essas proteínas também são chamadas de pequenas GTPases, pequenas proteínas de ligação a GTP ou superfamília de proteínas Ras e formam uma superfamília independente dentro da grande classe de GTP hidrolases com funções regulatórias..
Essas proteínas são muito diversas e controlam vários processos celulares. Eles são caracterizados por um domínio de ligação a GTP conservado, o domínio "G". A ligação desse nucleotídeo fosfato causa mudanças conformacionais importantes em seu domínio catalítico em proteínas G pequenas..
Sua atividade está intimamente relacionada às proteínas ativadoras de GTPase (GAP).Proteína ativadora de GTPase ") e com fatores de troca de nucleotídeo guanina (GEF)Fator de troca de nucleotídeo de guanina ”).
Cinco classes ou famílias de pequenas proteínas G foram descritas em eucariotos:
-Ras
-Rho
-Rab
-Sar1 / Arf
-Correu
As proteínas Ras e Rho controlam a expressão gênica e as proteínas Rho também modulam a reorganização do citoesqueleto. As proteínas do grupo Rab e Sar1 / Arf influenciam o transporte vesicular e as proteínas Ran regulam o transporte nuclear e o ciclo celular..
Proteínas G heterotriméricas
Esse tipo de proteína também merece associação com dois outros fatores protéicos, de forma que a via de sinalização do ambiente externo para o interior da célula seja composta por três elementos na seguinte ordem:
- O receptores acoplados para proteínas G
- As Proteínas G
- As proteína ou o canais efetores
Existe uma grande diversidade de proteínas G heterotriméricas e isso está relacionado à grande diversidade de subunidades α que existem na natureza, nas quais apenas 20% da sequência de aminoácidos é conservada..
Normalmente, as proteínas G heterotriméricas são identificadas graças à diversidade da subunidade α, baseada principalmente em suas semelhanças funcionais e de sequência..
As subunidades α são compostas por quatro famílias (a família Gs, a família Gi / o, a família Gq e a família G12). Cada família é composta por um “isótipo” diferente que, juntos, adiciona mais de 15 formas diferentes de subunidades α..
Família Gs
Esta família contém representantes que também participam da regulação positiva das proteínas adenilato ciclase e é expressa na maioria dos tipos de células. É composto por dois membros: Gs e Golf.
O subscrito "s " refere-se a estimulação (do inglês “estimulação ") e o subscrito “olf " refere-se a "cheiro" (do inglês "Olfato") As proteínas do golfe são expressas especialmente em neurônios sensoriais responsáveis pelo cheiro.
Família Gi / o
Esta é a maior e mais diversa família. Eles são expressos em muitos tipos de células e medeiam a inibição dependente do receptor de vários tipos de adenil ciclases (o subscrito “eu " refere-se a inibição).
As proteínas com as subunidades α do grupo Go são expressas especialmente em células do sistema nervoso central e têm duas variantes: A e B..
Família Go que
As proteínas com esta família de subunidades α são responsáveis pela regulação da fosfolipase C. Esta família consiste em quatro membros cujas subunidades α são expressas por genes diferentes. Eles são abundantes nas células do fígado, células renais e pulmões.
Família G12
Esta família é expressa de forma ubíqua nos organismos e não se sabe ao certo quais são exatamente os processos celulares regulados por proteínas com essas subunidades..
Subunidades Β e γ
Embora a diversidade de estruturas alfa seja decisiva para a identificação de proteínas heterotriméricas, também há muita diversidade em relação às outras duas subunidades: beta e gama..
Características
As proteínas G participam da "canalização" de sinais de receptores na membrana plasmática para canais ou enzimas efetoras..
O exemplo mais comum da função desse tipo de proteína está na regulação da enzima adenilato ciclase, enzima responsável pela síntese da adenosina 3 ', 5'-monofosfato ou simplesmente AMP cíclico, molécula que tem importantes funções como segundo mensageiro em muitos processos celulares conhecidos:
-Fosforilação seletiva de proteínas com funções específicas
-Transcrição genética
-Reorganização do citoesqueleto
-Secreção
-Despolarização da membrana
Também participam indiretamente da regulação da cascata de sinalização do inositol (fosfatidilinositol e seus derivados fosforilados), responsáveis pelo controle de processos cálcio-dependentes, como a quimiotaxia e a secreção de fatores solúveis..
Muitos canais iônicos e proteínas de transporte são controlados diretamente por proteínas da família das proteínas G. Da mesma forma, essas proteínas estão envolvidas em diversos processos sensoriais como visão, olfato, entre outros..
Como eles funcionam?
O modo de interação de uma proteína G com as proteínas efetoras é específico para cada classe ou família de proteínas.
Para proteínas G acopladas a receptores de membrana (proteínas G heterotriméricas), a ligação de um nucleotídeo de guanina, como GDP ou difosfato de guanosina à subunidade α, causa a associação das três subunidades, formando um complexo conhecido como Gαβγ ou G-GDP, que é preso à membrana.
Se a molécula de GDP for posteriormente trocada por uma molécula de GTP, a subunidade α ligada ao GTP se dissocia das subunidades β e γ, formando um complexo separado conhecido como Gα-GTP, que é capaz de alterar a atividade de suas enzimas ou proteínas transportadoras alvo.
A atividade hidrolítica dessa subunidade permite que ela encerre a ativação, trocando o GTP por um novo GDP, passando para a conformação inativa..
Na ausência de receptores excitados que se associam às proteínas G, esse processo de troca de GDP por GTP é muito lento, o que significa que proteínas G heterotriméricas apenas trocam GDP por GTP a uma taxa fisiologicamente significativa quando estão ligadas a seus receptores excitados..
Referências
- Gilman, G. (1987). Proteínas G: Transdutores de Sinais Gerados por Receptor. Avaliações anuais em bioquímica, 56, 615-649.
- Milligan, G., & Kostenis, E. (2006). Proteínas G heterotriméricas: uma breve história. British Journal of Pharmacology, 147, 546-555.
- Offermanns, S. (2003). Proteínas G como transdutores na sinalização transmembrana. Progresso em Biofísica e Biologia Molecular, 83, 101-130.
- Simon, M., Strathmann, M. P., & Gautam, N. (1991). Diversidade de proteínas G na transdução de sinal. Ciência, 252, 802-808.
- Syrovatkina, V., Alegre, K. O., Dey, R., & Huang, X. (2016). Funções de regulação, sinalização e fisiológicas das proteínas G. Journal of Molecular Biology, 428(19), 3850-3868.



Ainda sem comentários