
Características de reação reversível e exemplos

UMA reação reversível É aquele que em algum ponto de seu curso atinge um estado de equilíbrio no qual as concentrações dos reagentes e produtos permanecem constantes; ou seja, não variam, pois a velocidade com que um é consumido é a mesma com que o outro aparece. Também é dito que tal estado corresponde a um equilíbrio dinâmico.
No entanto, o equilíbrio pode ser visto como uma consequência da reversibilidade de uma reação química; já que em reações irreversíveis é impossível estabelecer qualquer equilíbrio. Para que isso aconteça, os produtos devem ser capazes de reagir entre si, sob condições específicas de pressão e temperatura, fazendo com que os reagentes retornem..
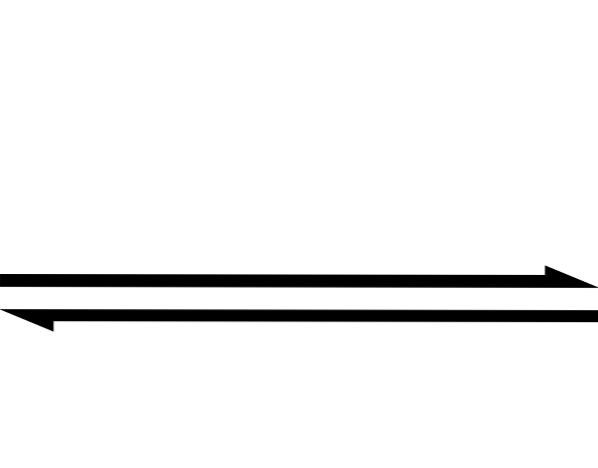
O texto acima é simplificado usando o símbolo de seta dupla (com duas cabeças antiparalelas). Quando o vemos em uma equação química, significa que a reação ocorre em ambas as direções: da esquerda para a direita (formação de produtos) e da direita para a esquerda (formação de reagentes ou reagentes).
A minoria das reações químicas é reversível e é encontrada principalmente em sínteses orgânicas e inorgânicas. Nestes, é extremamente importante saber quais as condições que favorecem o equilíbrio para estimar as quantidades de produto que podem ser obtidas..
Índice do artigo
- 1 Características das reações reversíveis
- 1.1 Equação geral e equilíbrio
- 1.2 Princípio Le Châtelier
- 1.3 Mudanças químicas
- 1.4 Espécies Químicas
- 2 Exemplos de reações reversíveis
- 2.1 Solução de cloreto de cobalto
- 2.2 Iodeto de hidrogênio
- 2.3 Hidrólise
- 2.4 Solução de cromato-dicromato
- 2,5 amônia
- 2.6 Esterificação
- 3 referências
Características das reações reversíveis
Equação geral e equilíbrio
Uma reação reversível tem a seguinte equação geral, considerando que existem apenas dois reagentes, A e B:
A + B ⇌ C + D
A seta dupla indica que A e B reagem para produzir C e D, mas também C e D podem reagir entre si para regenerar os reagentes; ou seja, a reação na direção oposta, da direita para a esquerda, ocorre.
A reação direta produz produtos, enquanto o inverso, reativo. Se um é exotérmico, o outro deve ser logicamente endotérmico e ambos ocorrem espontaneamente; mas não necessariamente na mesma velocidade.
Por exemplo, A e B podem ser menores ou instáveis do que C e D; e que, portanto, eles são consumidos mais rápido do que C e D podem regenerá-los.
Se os produtos C e D quase não reagem um com o outro, haverá um maior acúmulo de produtos do que reagentes. Isso significa que quando o equilíbrio químico for alcançado, teremos maiores concentrações de C e D do que de A ou B, independentemente de suas concentrações não variarem..
Diz-se que o equilíbrio é deslocado para a esquerda, onde haverá mais produtos do que reagentes.
Princípio Le Châtelier
Uma reação reversível é caracterizada por ocorrer em ambas as direções em uma equação química, atingindo um ponto de equilíbrio e respondendo a mudanças externas ou influências seguindo o princípio de le Châtelier..
Na verdade, graças a esse princípio, as observações de Berthollet em 1803, quando ele reconheceu os cristais de Na, puderam ser explicadas.doisCO3 em um lago arenoso localizado no Egito. A reação de duplo deslocamento seria:
N / DdoisCO3(ac) + CaCldois(ac) ⇌ NaCl (aq) + CaCO3(ac)
Para que a reação reversa ocorra, deve haver um excesso de NaCl, e assim o equilíbrio mudaria para a direita: em direção à formação de NadoisCO3.
Esta característica é de grande importância porque, da mesma forma, pressões ou temperaturas são manipuladas para favorecer o sentido da reação gerada pela espécie de interesse..
Mudanças químicas
As alterações químicas para reações reversíveis tendem a ser menos óbvias do que aquelas observadas para reações irreversíveis. No entanto, existem reações, especialmente aquelas envolvendo complexos metálicos, nas quais vemos mudanças de cor dependentes da temperatura..
Compostos químicos
Qualquer tipo de composto pode estar envolvido em uma reação reversível. Foi visto que dois sais são capazes de estabelecer um equilíbrio, NadoisCO3 e CaCldois. O mesmo acontece entre complexos ou moléculas de metal. Na verdade, muitas das reações reversíveis são devidas a moléculas com ligações específicas que se quebram e se regeneram continuamente..
Exemplos de reações reversíveis
Solução de cloreto de cobalto
Uma solução de cloreto de cobalto, CoCldois, em água mancha de rosa, devido à formação de um aquoso complexo. Quando esta solução é aquecida, a cor muda para azul, dando a seguinte reação reversível:
[Co (HdoisOU)6]dois+(ac) (rosa) + 4Cl-(ac) + Q ⇌ CoCl4dois-(ac) (azul) + 6HdoisO (l)
Onde Q é o calor fornecido. Este calor desidrata o complexo, mas conforme a solução esfria, ou se água for adicionada, ele retornará à sua cor rosa original..
Iodeto de hidrogênio
A seguinte reação reversível é talvez a mais clássica na introdução do conceito de equilíbrio químico:
Hdois(g) + Idois(s) ⇌ 2HI (g)
Observe que a reação consegue estabelecer um equilíbrio mesmo quando o iodo está no estado sólido. Todas as espécies são moleculares: H-H, I-I e H-I.
Hidrólise
As hidrólises são exemplos muito representativos de reações reversíveis. Entre os mais simples, temos aquele que sofre um ácido ou base conjugado. Hidrólise do íon amônio, NH4+, e o íon carbonato, CO3dois-, são as seguintes:
NH4+(ac) + HdoisO (l) ⇌ NH3(g) + OH-
CO3dois-(ac) + HdoisO (l) ⇌ HCO3-(ac) + OH-
Se adicionarmos uma base que contribui com íons OH- para o meio, vamos deslocar os dois saldos para a esquerda.
Solução de cromato-dicromato
Muito semelhante ao do primeiro exemplo, uma solução de cromato sofre uma mudança de cor, mas devido a variações na temperatura, mas não no pH. A reação reversível é:
2CrO4dois-(ac) (amarelo) + 2H3OU+(ac) ⇌ CrdoisOU7dois-(ac) (laranja) + 3HdoisO (l)
Então, se para uma solução amarela de CrO4dois- se for acidificado com qualquer ácido, sua cor ficará laranja imediatamente. E se for então alcalinizada ou se for adicionada água abundante, o equilíbrio mudará para a direita, a cor amarela reaparecendo e o Cr sendo consumido.doisOU7dois-.
Amônia
A síntese de amônia, NH3, Envolve uma reação reversível ajustada para que o nitrogênio gasoso, uma espécie muito inerte, reaja:
Ndois(g) + 3Hdois(s) ⇌ 2NH3(g)
Esterificação
E, por fim, cita-se um exemplo de química orgânica: a esterificação. Consiste na obtenção de um éster de um ácido carboxílico e de um álcool em meio de ácido forte. A reação reversível é:
RCOOH + R'OH ⇌ RCOOR '+ HdoisOU
Referências
- Whitten, Davis, Peck & Stanley. (2008). Química. (8ª ed.). CENGAGE Learning.
- Walter J. Moore. (1963). Química Física. Em cinética química. Quarta edição, Longmans.
- Ira N. Levine. (2009). Princípios de Físicoquímica. Sexta edição, pp. 479-540. Mc Graw Hill.
- Wikipedia. (2020). Reação reversível. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (19 de agosto de 2019). Definição e exemplos de reação reversível. Recuperado de: Thoughtco.com
- Binod Shrestha. (5 de junho de 2019). Reações reversíveis e irreversíveis. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- David Wood. (2020). Reações químicas reversíveis: definição e exemplos. Estudar. Recuperado de: study.com



Ainda sem comentários