
Características do receptor de insulina, estrutura, funções
O receptores de insulina São estruturas protéicas expostas no lado extracelular da membrana plasmática de muitas células do corpo humano e de outros mamíferos. O ligante natural deste receptor é a insulina.
A insulina é um hormônio sintetizado pelas células ß das ilhotas de Langerhans da porção endócrina do pâncreas, um órgão localizado na cavidade abdominal que sintetiza enzimas digestivas e hormônios.
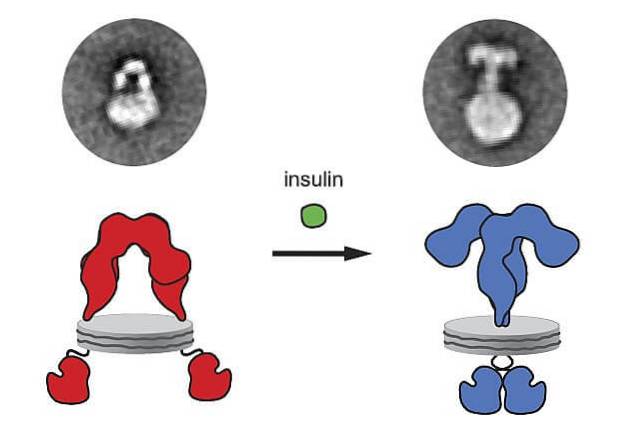
A insulina sintetizada e liberada pelo pâncreas se liga ao seu receptor na membrana plasmática das células-alvo e, como consequência dessa ligação ligante-receptor, uma série de processos intracelulares são desencadeados que finalmente promovem a entrada de glicose nas referidas células..
A insulina é responsável pela ativação de muitas reações anabólicas ou sintéticas relacionadas ao metabolismo de carboidratos, gorduras e proteínas..
Os receptores de insulina são glicoproteínas formadas por quatro subunidades com suas porções amino e carboxila terminais na região citoplasmática. Quando esses receptores se ligam à insulina, eles se agregam e endocitam.
Na obesidade e no diabetes tipo II, o número de receptores de insulina diminui e isso explica em parte a resistência à insulina que acompanha essas condições patológicas.
Índice do artigo
- 1 recursos
- 2 Estrutura
- 3 funções
- 4 doenças
- 5 referências
Caracteristicas
Os receptores de insulina fazem parte de uma família de receptores de membrana que possuem locais de ligação para hormônios de natureza proteica. Esse tipo de hormônio não consegue atravessar as membranas celulares, de modo que seus efeitos metabólicos são realizados por meio de seus receptores..
A insulina é um hormônio peptídico relacionado à promoção de reações sintéticas coletivamente chamadas de reações anabólicas, que estão relacionadas ao metabolismo de carboidratos, gorduras e proteínas..
Muitas células têm receptores de insulina, principalmente células musculares, células do fígado e células do tecido adiposo. No entanto, outras células que aparentemente não são células-alvo da insulina também possuem receptores de insulina..
A entrada da glicose nas células, em alguns tecidos, é dependente da insulina, pois, nelas, as proteínas responsáveis pela difusão facilitada da glicose encontram-se em pequenos pedaços de membrana formando vesículas intracelulares..
Quando a insulina se liga ao seu receptor nesse tipo de células insulino-dependentes, os transportadores de glicose localizados nas vesículas intracelulares se movem e aparecem na superfície da membrana celular quando essas vesículas se fundem com essa membrana..
O músculo esquelético e as células do tecido adiposo são, entre outros, um exemplo desse mecanismo..
Os receptores de insulina têm meia-vida relativamente curta, de cerca de 7 a 12 horas, portanto, são constantemente sintetizados e degradados. Em mamíferos, a concentração de receptores é de aproximadamente 20.000 receptores por célula..
Quando a insulina se liga ao receptor, ocorre uma mudança conformacional do receptor, os receptores vizinhos se movem, microagregados são produzidos e então o receptor é internalizado. Ao mesmo tempo, são gerados os sinais que irão amplificar as respostas..
Estrutura
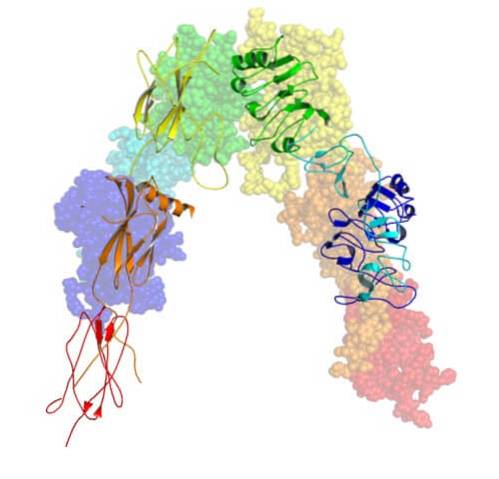
O gene que codifica o receptor de insulina está localizado no cromossomo 19 e possui 22 exons. Este receptor é composto por quatro subunidades de glicoproteínas ligadas por dissulfeto..
É sintetizado no retículo endoplasmático inicialmente como uma única cadeia polipeptídica de cerca de 1.382 aminoácidos que é então fosforilada e clivada para formar as subunidades α e β..
As quatro subunidades do receptor de insulina são dois alfas (α) com peso molecular de 140.000 Da e dois betas menores (β), com peso molecular aproximado de 95.000 Da.
As subunidades α são extracelulares e estão expostas na superfície externa da membrana celular. As subunidades β, por outro lado, atravessam a membrana e expõem ou projetam-se na superfície interna da membrana (voltada para o citoplasma).
As subunidades α contêm o local de ligação da insulina. Nas unidades β existe um sítio de ligação para ATP que ativa a função quinase desta subunidade e induz a autofosforilação do receptor nos resíduos de tirosina da subunidade β..
Esses receptores fazem parte de uma família de receptores associados a enzimas citoplasmáticas como a tirosina-quinase, uma enzima que é ativada quando a insulina se liga ao receptor e inicia um processo de fosforilação e desfosforilação de uma série de enzimas que serão responsáveis pelos efeitos . insulina metabólica.
Características
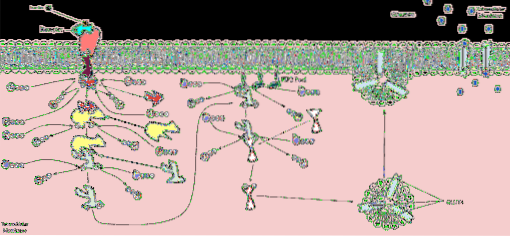
A subunidade α dos receptores de insulina tem o local de ligação para a insulina. Quando essa unidade se liga ao seu ligante, ocorrem mudanças conformacionais na estrutura do receptor que ativam as subunidades β, responsáveis pelos mecanismos de transdução de sinal e, portanto, pelos efeitos da insulina..
Nos domínios citoplasmáticos do receptor, uma tirosina quinase é ativada e inicia a transmissão de sinais por meio de uma cascata de quinases. A primeira coisa que acontece é a fosforilação ou autofosforilação do receptor de insulina e então os chamados substratos do receptor de insulina ou IRS são fosforilados..
Quatro substratos do receptor de insulina designados IRS-1, IRS-2, IRS-3 e IRS-4 foram descritos. Sua fosforilação ocorre em resíduos de tirosina, serina e treonina. Cada um desses substratos está relacionado a diferentes cascatas de quinase envolvidas nos efeitos metabólicos da insulina..
Por exemplo:
- IRS-1 parece estar relacionado ao efeito da insulina no crescimento celular.
- Os IRS -2 estão relacionados aos efeitos metabólicos do hormônio, como o aumento da síntese de glicogênio, lipídios e proteínas, e à translocação de proteínas, como proteínas receptoras e proteínas transportadoras de glicose..
Doenças
O diabetes é uma doença que atinge uma porcentagem muito elevada da população mundial e está relacionada a defeitos na produção de insulina, mas também a uma função deficiente dos receptores de insulina..
Existem dois tipos de diabetes: diabetes tipo I ou diabetes juvenil, que é dependente de insulina, e diabetes tipo II ou diabetes adulto, que não é dependente de insulina..
O diabetes tipo I é devido à produção insuficiente de insulina e está associado à hiperglicemia e cetoacidose. O diabetes tipo II está relacionado a fatores genéticos que afetam a produção de insulina e a função do receptor e está associado à hiperglicemia sem cetoacidose.
Referências
- American Diabetes Association. (2010). Diagnóstico e classificação de diabetes mellitus. Cuidados com a diabetes, 33 (Suplemento 1), S62-S69.
- Berne, R., & Levy, M. (1990). Fisiologia. Mosby; Edição internacional de ed.
- Fox, S. I. (2006). Human Physiology (9ª ed.). Nova York, EUA: McGraw-Hill Press.
- Guyton, A., & Hall, J. (2006). Textbook of Medical Physiology (11ª ed.). Elsevier Inc.
- Lee, J., & Pilch, P. F. (1994). O receptor de insulina: estrutura, função e sinalização. American Journal of Physiology-Cell Physiology, 266 (2), C319-C334.



Ainda sem comentários