
Estrutura, propriedades, usos e síntese do salicilato de metila

O salicilato de metila É uma substância química, de natureza orgânica, considerada o composto com maior toxicidade entre os salicilatos conhecidos, apesar de seu aspecto incolor e de cheiro agradável com leve toque adocicado. Esta espécie é mais conhecida pelo nome de óleo de gaultéria..
Encontra-se no estado líquido em condições padrão de temperatura e pressão (25 ° C e 1 atm), constituindo um éster orgânico que ocorre naturalmente em uma grande variedade de plantas. A partir da observação e estudo de sua produção na natureza, foi possível proceder à síntese do salicilato de metila..

Essa síntese foi realizada por meio de uma reação química entre o éster do ácido salicílico e sua combinação com o metanol. Desta forma, este composto faz parte da salva, do vinho branco e de frutas como ameixas e maçãs, entre outras encontradas naturalmente..
Sinteticamente, o salicilato de metila é usado na produção de agentes aromatizantes, bem como em certos alimentos e bebidas..
Índice do artigo
- 1 Estrutura química
- 2 propriedades
- 3 usos
- 4 Síntese
- 5 referências
Estrutura química
A estrutura química do salicilato de metila é composta por dois grupos funcionais principais (um éster e um fenol ligados a ele), conforme mostrado na imagem acima.
Observa-se que é constituído por um anel benzênico (que representa uma influência direta na reatividade e estabilidade do composto), proveniente do ácido salicílico do qual é derivado..
Para nomeá-los separadamente, pode-se dizer que um grupo hidroxila e um éster metílico estão ligados na posição orto (1,2) ao anel mencionado..
Então, à medida que o grupo OH se liga ao anel benzênico, forma-se um fenol, mas o grupo que possui a maior “hierarquia” nessa molécula é o éster, conferindo a esse composto uma estrutura particular e, portanto, características bastante específicas..
Desta forma, seu nome químico é apresentado como 2-hidroxibenzoato de metila, concedido pela IUPAC, embora seja menos utilizado para se referir a este composto..
Propriedades
- É uma espécie química pertencente ao grupo dos salicilatos, que são produtos de origem natural do metabolismo de alguns organismos vegetais..
- As propriedades terapêuticas dos salicilatos em tratamentos médicos são conhecidas.
- Este composto está presente em certas bebidas, como vinho branco, chá, sálvia e certas frutas, como mamão ou cereja..
- É encontrada naturalmente nas folhas de um grande número de plantas, especialmente em certas famílias.
- Pertence ao grupo dos ésteres orgânicos que podem ser sintetizados em laboratório.
- É obtido no estado líquido, cuja densidade é de aproximadamente 1.174 g / ml em condições padrão de pressão e temperatura (1 atm e 25 ° C)..
- Forma uma fase líquida incolor, amarelada ou avermelhada, considerada solúvel em água (que é um solvente inorgânico) e em outros solventes orgânicos.
- Seu ponto de ebulição é de aproximadamente 222 ° C, manifestando sua decomposição térmica em torno de 340 a 350 ° C.
- Ele tem várias aplicações, que vão desde agentes aromatizantes na indústria de doces até analgésicos e outros produtos na indústria farmacêutica.
- Sua fórmula molecular é representada como C8H8OU3 e tem uma massa molar de 152,15 g / mol.
Formulários
Devido às suas características estruturais, por ser um éster metílico de ácido salicílico, o salicilato de metila tem um grande número de aplicações em diferentes áreas..
Uma das principais utilizações (e as mais conhecidas) desta substância é como aromatizante em diversos produtos: da indústria cosmética como fragrância à indústria alimentar como aromatizante em doces (gomas de mascar, balas, gelados, entre outros ).
Também é usado na indústria cosmética como agente de aquecimento e para massagem muscular em aplicações esportivas. No último caso, atua como um rubefaciente; ou seja, causa vermelhidão superficial da pele e membranas mucosas quando em contato com estes.
Da mesma forma, é utilizado em um creme de uso tópico, devido às suas propriedades analgésicas e antiinflamatórias em tratamentos de doenças reumáticas..
Outra de suas aplicações é o uso de líquidos em sessões de aromaterapia, devido às características de seu óleo essencial..
Além de seu uso como agente de proteção contra a radiação ultravioleta em filtros solares, suas propriedades contra a luz são investigadas para aplicações tecnológicas, como a produção de raios laser ou a criação de espécies sensíveis ao armazenamento de informações em moléculas..
Síntese
Em primeiro lugar, deve-se mencionar que o salicilato de metila pode ser obtido naturalmente a partir da destilação dos ramos de certas plantas, como a gaultéria (Gaultheria procumbens) ou bétula doce (Betula lenta).
Essa substância foi extraída e isolada pela primeira vez em 1843, graças ao cientista de origem francesa Auguste Cahours; da gaultéria, atualmente é obtido por síntese em laboratório e até comercialmente.
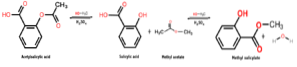
A reação para a obtenção desse composto químico é um processo denominado esterificação, no qual um éster é obtido pela reação entre um álcool e um ácido carboxílico. Nesse caso, ocorre entre o metanol e o ácido salicílico, conforme mostrado a seguir:
CH3OH + C7H6OU3 → C8H8OU3 + HdoisOU
Deve-se notar que a parte da molécula de ácido salicílico que é esterificada com o grupo hidroxila (OH) do álcool é o grupo carboxila (COOH).
Então, o que ocorre entre essas duas espécies químicas é uma reação de condensação, pois a molécula de água presente entre os reagentes é removida enquanto as demais espécies reagentes são condensadas para se obter o salicilato de metila..
A imagem a seguir mostra a síntese de salicilato de metila a partir do ácido salicílico, onde duas reações sucessivas são mostradas.
Referências
- Wikipedia. (s.f.). Salicilato de metila. Recuperado de en.wikipedia.org
- Britannica, E. (s.f.). Salicilato de metila. Obtido em britannica.com
- Concelho Europeu. Comitê de Especialistas em Produtos Cosméticos. (2008). Ingredientes ativos usados em cosméticos: Pesquisa de segurança. Recuperado de books.google.co.ve
- Dasgupta, A. e Wahed, A. (2013). Química Clínica, Imunologia e Controle de Qualidade Laboratorial. Obtido em books.google.co.ve
- PubChem. (s.f.) Salicilato de metilo. Recuperado de pubchem.ncbi.nlm.nih.gov



Ainda sem comentários