
Estrutura do sulfato de alumínio (Al2 (SO4) 3), usos, toxicidade

O sulfato de alumínio é um sal de alumínio inorgânico de fórmula Aldois(SW4)3, que geralmente aparece como um sólido branco com cristais brilhantes. A cor do composto será influenciada por sua concentração de ferro e quaisquer outras impurezas. Existem dois tipos principais de sulfato de alumínio: A e B.
A imagem inferior mostra cristais brancos de sulfato de alumínio hidratado. A ausência de colorações marrons pode ser notada, indicativo de íons de ferro dentro da rede cristalina.

O sulfato de alumínio é um sal muito solúvel em água e na natureza é raro encontrá-lo em sua forma anidra. Geralmente é hidratado na forma de sulfato de alumínio octadeca-hidratado [Aldois(SW4)3.18HdoisO] ou hexadecahidrato [Aldois(SW4)3.16hdoisOU].
Da mesma forma, pode formar sais duplos com o potássio e com o amônio, compostos conhecidos como alúmen. Em parte, isso pode ser devido à afinidade da água dentro dos hidratos para reter íons diferentes do alumínio..
O sulfato de alumínio pode ser decomposto pela ação da água em hidróxido de alumínio e ácido sulfúrico. Esta propriedade permite seu uso como acidificante do solo..
Também é um composto tóxico, principalmente quando em contato com sua poeira. No entanto, possui uma miríade de utilizações e aplicações que vão desde a purificação da água pelo método de coagulação, passando pela sua utilização em várias indústrias, até à sua utilização para fins terapêuticos..
Índice do artigo
- 1 Estrutura
- 2 Para que serve (usa)
- 2.1 Coagulação ou floculação de água
- 2.2 Use como mordente de tinta e na fabricação de papel
- 2.3 Usos industriais
- 2.4 Usos medicinais e terapêuticos
- 2.5 Outros usos
- 3 Produção de sulfato de alumínio
- 4 tipos
- 5 Toxicidade
- 6 referências
Estrutura
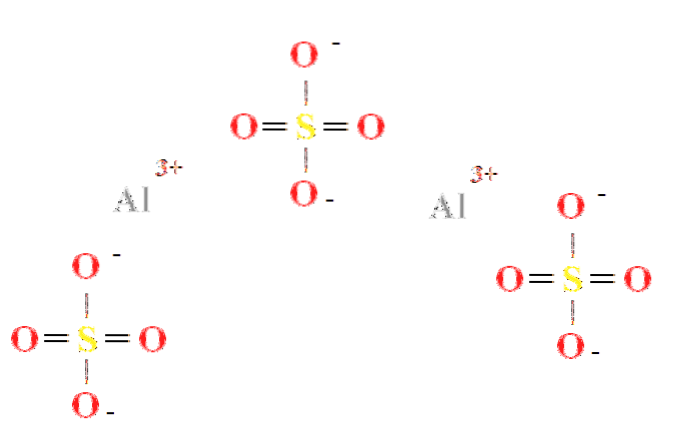
O sulfato de alumínio tem uma proporção de dois cátions Al3+ para cada três ânions SO4dois- (imagem superior), que pode ser visto diretamente em sua fórmula química Aldois(SW4)3.
Observe que o Al3+ são acinzentados, enquanto o SO4dois- eles são amarelos (para o átomo de enxofre) e vermelhos (para os átomos de oxigênio).
A estrutura ilustrada corresponde à forma anidra de Aldois(SW4)3, uma vez que nenhuma molécula de água interage com os íons. Em seus hidratos, no entanto, a água pode ser atraída pelos centros positivos de Al3+, ou pelo tetraedro negativo de SO4dois- por ligação de hidrogênio (HOH- O-SO3dois-).
Aldois(SW4)3∙ 18HdoisOu, por exemplo, contém 18 moléculas de água em sua estrutura sólida. Alguns deles podem estar em contato direto com a Al3+ ou com o SO4dois-. Em outras palavras: o sulfato de alumínio pode ter água coordenada interna ou externa.
Da mesma forma, sua estrutura pode hospedar outros cátions, como Fe3+, N / D+, K+, etc. Mas para isso, a presença de mais ânions SO é necessária4dois-. Para que? Para neutralizar o aumento das cargas positivas devido às impurezas metálicas.
O sulfato de alumínio pode ter várias estruturas, embora seus hidratos tendam a adotar o sistema de cristal monoclínico.
Propriedades físicas e químicas
Aparência
Aparece como um sólido com cristais, grânulos ou pó brancos brilhantes.
Peso molecular
342,31 g / mol (anidro).
Odor
É inodoro
Gosto
Gosto doce levemente adstringente.
Ponto de fusão
Forma anidra 770º C (forma octadeca-hidratada 86,5º C)
Solubilidade em água
31,2 g / 100 ml a 0 ° C; 36,4 g / 100 ml a 20 ° C e 89 g / 100 ml a 100 ° C.
Densidade
2,67 a 2,71 g / cm3.
Solubilidade
Ligeiramente solúvel em álcool etílico.
Pressão de vapor
Essencialmente zero.
Estabilidade
Estável no ar.
Decomposição
Quando aquecido, aproximadamente ao ponto de fusão, pode se decompor, emitindo principalmente óxido de enxofre, um gás tóxico..
Corrosividade
As soluções de sulfato de alumínio são corrosivas para o alumínio. Da mesma forma, o composto pode corroer metais na presença de umidade..
pKa
3,3 a 3,6. E seu pH é 2,9 ou mais em uma solução aquosa a 5%.
Para que serve (usa)
Coagulação ou floculação de água
-Al mezclarse con el agua (potable, servida o de desecho), el sulfato de aluminio origina hidróxido de aluminio, el cual forma complejos con los compuestos y las partículas en solución acelerando su sedimentación, lo cual en ausencia del tratamiento con sulfato de aluminio tardaría muito tempo.
-O sulfato de alumínio também é usado para limpar a água da piscina, tornando-a mais atraente de usar..
-Com o uso do sulfato de alumínio, consegue-se uma água destituída de turbidez e cor, aumentando sua potabilidade ao facilitar a limpeza da água. Infelizmente, este método de purificação pode levar a um aumento ligeiramente na concentração de alumínio na água..
-O alumínio é um metal muito tóxico que se acumula na pele, no cérebro e nos pulmões, causando graves distúrbios. Além disso, não se sabe que função ele desempenha nos seres vivos..
-A União Europeia exige que o limite máximo permitido para o alumínio na água não exceda 0,2 mg / l. Enquanto isso, a Agência de Proteção Ambiental dos EUA exige que o limite máximo de contaminação da água com alumínio não exceda 0,05-0,2 mg / l.
-O tratamento de águas residuais ou efluentes com sulfato de alumínio permite a eliminação ou redução do fósforo presente nas mesmas, de forma econômica.
Use como mordente de tinta e na fabricação de papel
-O sulfato de alumínio tem sido utilizado como mordente em corantes ou tintas, auxiliando na fixação no material a ser tingido. Sua ação fixadora é devida ao Al (OH)3, cuja consistência gelatinosa colabora com a adsorção de corantes em tecidos.
-Embora tenha sido usado desde aproximadamente 2.000 aC para a finalidade descrita, apenas os corantes orgânicos requerem mordentes. Os corantes sintéticos, por outro lado, não requerem mordentes para cumprir sua função..
-Ela foi substituída pela fabricação de papel, mas ainda é usada na fabricação de celulose. Ele remove suas impurezas, assim como também tem sido usado para ligar materiais, neutralizar cargas e calibrar a colofônia..
Usos industriais
-É utilizado na indústria da construção para acelerar a pega do concreto. Além disso, é utilizado na impermeabilização de construções.
-Na indústria de sabão e graxa é utilizado na produção de glicerina.
-É utilizado na indústria do petróleo na produção de catalisadores sintéticos que utilizam durante sua operação..
-É utilizado na indústria farmacêutica como adstringente na preparação de medicamentos e cosméticos.
-Participa da elaboração de corantes como o carmim. Também é usado como corante na fabricação de borrachas sintéticas de estireno-butadieno..
-Na indústria de fabricação de açúcar, é usado como purificador do melaço de cana-de-açúcar.
-É utilizado na fabricação de desodorantes. Por quê? Porque causa um estreitamento dos dutos das glândulas sudoríparas, limitando assim o acúmulo de suor, um meio necessário para o crescimento de bactérias causadoras de odores.
-É utilizado no curtimento do couro, processo necessário à sua utilização. Além disso, é utilizado na fabricação de fertilizantes.
-É utilizado como aditivo na fabricação de tintas, adesivos e selantes, bem como em produtos de limpeza e cuidados com móveis.
Usos medicinais e terapêuticos
-O sulfato de alumínio é um adjuvante imunológico. Portanto, cumpre a função de processar antígenos de tal forma que, ao serem liberados em seu sítio de ação, produzam maior produção de anticorpos para os antígenos inoculados..
-O adjuvante de Freund e o BCG, assim como outros adjuvantes, inclusive endógenos, como as interleucinas, são inespecíficos para antígenos, permitindo um aumento do raio de ação imune. Isso tem permitido o desenvolvimento de vacinas contra inúmeras doenças.
-A ação coagulante do sulfato de alumínio tem permitido a eliminação de inúmeros vírus na água tratada, entre outros: Q beta, MS2, T4 e P1. Os resultados indicam que o tratamento da água com sulfato de alumínio produz a inativação desses vírus..
-O sulfato de alumínio é utilizado em forma de bastão ou em pó no tratamento de pequenas feridas superficiais ou abrasões produzidas pelo barbear..
-É usado na fabricação de acetato de alumínio, um composto usado no tratamento de algumas doenças do ouvido. Também tem sido usado, sem sucesso significativo, para aliviar as consequências de picadas de formigas de fogo..
-Soluções de sulfato de alumínio são utilizadas, na concentração de 5% a 10%, no tratamento local de úlceras que permitem o controle de suas secreções..
-A ação adstringente do sulfato de alumínio contrai as camadas superficiais da pele, coagulando proteínas e cicatrizando feridas.
Outros usos
-O sulfato de alumínio ajuda a controlar o crescimento excessivo de algas em lagoas, lagos e riachos. Também é utilizado na eliminação de moluscos, entre outros a lesma espanhola..
-Jardineiros aplicam este composto para acidificar solos alcalinos. Em contato com sua água, o sulfato de alumínio se decompõe em hidróxido de alumínio e ácido sulfúrico diluído. Em seguida, o hidróxido de alumínio precipita, deixando o ácido sulfúrico em solução..
-A acidificação dos solos devido ao ácido sulfúrico é visualizada de forma muito criativa, devido à existência de uma planta chamada Hortênsia, cujas flores ficam azuis na presença de um solo ácido; ou seja, eles são sensíveis e respondem às mudanças no pH.
-O sulfato de alumínio está envolvido na produção de uma espuma para combater e controlar o fogo. Como? Reage com o bicarbonato de sódio, causando a liberação de COdois. Este gás bloqueia o acesso do Odois para o local de combustão do material; e, consequentemente, o cessar-fogo que se desenrolava.
Produção de sulfato de alumínio
O sulfato de alumínio é sintetizado pela reação de um composto rico em alumínio, como o mineral bauxita, com ácido sulfúrico em temperaturas elevadas. A seguinte equação química representa a reação:
Para odoisOU3 + HdoisSW4 -> Aldois(SW4)3 + 3 HdoisOU
O sulfato de alumínio também pode ser formado por uma reação de neutralização entre hidróxido de alumínio e ácido sulfúrico, de acordo com a seguinte reação:
2 Al (OH)3 + 3 HdoisSW4 + 12 hdoisO -> Aldois(SW4)3.18HdoisOU
O ácido sulfúrico reage com o alumínio para formar sulfato de amônio e liberar moléculas de hidrogênio como um gás. A reação é descrita da seguinte forma:
2 Al + 3 HdoisSW4 -> Aldois(SW4)3 + 3 Hdois
Tipos
O sulfato de alumínio é classificado em dois tipos: tipo A e tipo B. No sulfato de alumínio tipo A, os sólidos são de cor branca e têm uma concentração de ferro inferior a 0,5%.
No sulfato de alumínio tipo B, os sólidos são de cor marrom e têm uma concentração de ferro inferior a 1,5%.
Existem indústrias produtoras de sulfato de alumínio que possuem diferentes critérios para sua classificação. Assim, uma indústria relata para sua preparação de sulfato de alumínio tipo A uma concentração máxima de 0,1% de ferro como óxido férrico. Enquanto para o tipo B, eles indicam uma concentração máxima de ferro de 0,35%.
Toxicidade
-O sulfato de alumínio é um composto que exerce sua ação tóxica pelo contato com sua poeira, causando irritação na pele e, nos casos de contato frequente, dermatites..
-Nos olhos, causa irritação severa, causando até lesões permanentes.
-A inalação causa irritação no nariz e na garganta, o que pode causar tosse e tosse áspera.
-Sua ingestão causa irritação gástrica, náuseas e vômitos.
-Existem efeitos tóxicos que não são devidos diretamente ao sulfato de alumínio, mas indiretamente ao seu uso. É o caso de certos efeitos tóxicos do alumínio, causados pelo uso do sulfato de alumínio na purificação da água..
-Pacientes que são cronicamente dialisados com sais preparados em água purificada, por meio do uso de sulfato de alumínio, apresentam problemas de saúde muito graves. Entre esses distúrbios, temos anemia, demência por diálise e aumento de doenças ósseas.
Referências
- Wikipedia. (2018). Sulfato de alumínio. Retirado de: en.wikipedia.org
- Aris Industrial. Solução de sulfato de alumínio tipo A e B. Retirado de: aris.com.pe
- Christopher Boyd. (9 de junho de 2014). Principais usos industriais para sulfato de alumínio. Retirado de: chemservice.com
- PubChem. (2018). Sulfato de Alumínio Anidro. Retirado de: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals. (20 de agosto de 2009). Folha de Segurança de Sulfato de Alumínio. [PDF]. Retirado de: andesia.com
- Livro Químico. (2017). Sulfato de Alumínio. Retirado de: chemicalbook.com

Ainda sem comentários