
Estrutura, propriedades, síntese do sulfato de ferro (FeSO4)

O Sulfato de ferro é um sal inorgânico cuja fórmula química é FeSO4. É constituído por um sólido cristalino de cor variável, obtido industrialmente como subproduto do processamento do aço..
É encontrado na natureza em diferentes formas, sendo a mais comum o sulfato ferroso heptahidratado, FeSO47hdoisO ("vitríolo verde", presente no mineral melenterita). Este hidrato é facilmente distinguido pela cor verde-azulada de seus cristais (imagem inferior). Outros hidratos têm a fórmula geral FeSO4XHdoisOu, onde x varia de 1 a 7.

O sulfato ferroso heptahidratado perde moléculas de água com o aquecimento e pode ser transformado em outras formas de sulfato ferroso; assim, ao ser aquecido a 57 ºC, perde três moléculas de água e se transforma em sulfato ferroso tetrahidratado. Quantos no total você pode perder? Sete moléculas de água, ou seja, muita água.
O sulfato ferroso é usado no tratamento e prevenção da anemia por deficiência de ferro. No entanto, pode ter efeitos tóxicos, por isso é preciso ter cuidado na dosagem.
Por outro lado, este sal de ferro tem inúmeras utilizações e aplicações que incluem a coloração de materiais têxteis e couro; agente redutor químico; dosímetro de radiação; agente conservante de madeira. Também é utilizado na prevenção da clorose em plantas e em processos de gravura e litografia..
O FeSO4 pode oxidar no ar para sulfato de ferro (III), Fedois(SW4)3 a uma taxa que pode ser aumentada pela temperatura, luz ou aumento do pH.
Muitas das propriedades físicas e químicas do sulfato ferroso, como solubilidade em água, ponto de fusão, tipo de cristais que ele forma e densidade, dependem do número de moléculas de água incorporadas nos cristais; ou seja, de seus hidratos.
Índice do artigo
- 1 Estrutura do sulfato de ferro
- 1.1 Acidez
- 2 Propriedades físicas e químicas
- 2.1 Nomes
- 2.2 Fórmula molecular
- 2.3 Peso molecular
- 2.4 Aparência física
- 2,5 Odor
- 2.6 Densidade
- 2.7 Ponto de fusão
- 2.8 Solubilidade em água
- 2.9 Solubilidade em álcool
- 2.10 Pressão de vapor
- 2.11 Índice de refração
- 2.12 Estabilidade
- 2.13 Decomposição
- 2.14 Reações
- 3 Síntese
- 3.1 De lã de aço
- 3.2 De pirita
- 4 riscos
- 5 usos
- 5.1 Na agricultura
- 5.2 Como reagente e na indústria
- 5.3 Na medicina e para fortificação de alimentos
- 5.4 Outros
- 6 referências
Estrutura do sulfato de ferro
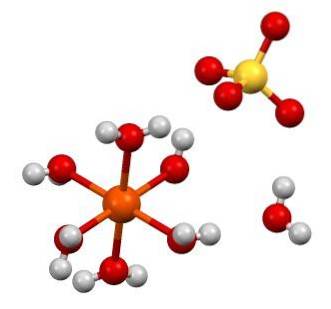
A fórmula química FeSO4 destaca que este sal é composto de íons Fedois+ Eu sou4dois- em uma proporção de 1: 1. Ambos os íons interagem por meio de forças eletrostáticas de tal forma que estão dispostos em um sistema de cristal ortorrômbico; que, logicamente, corresponde ao sal anidro.
Na imagem superior, por outro lado, é mostrada a estrutura do FeSO47hdoisO. A esfera laranja representa o Fe cátiondois+, que, como pode ser visto, se coordena com seis moléculas de água para formar um octaedro. O fardo da fédois+ atrai o ânion SO4dois-, e este, por sua vez, se observado, forma uma ligação de hidrogênio com a sétima molécula de água.
A sétima molécula de água (aquela que está distante do octaedro), também forma outra ligação de hidrogênio com outra molécula de água pertencente a um octaedro vizinho. O resultado dessas interações é que o cristal muda de ortorrômbico para monoclínico..
Como os cristais de FeSO4 hidrato anidro, os ânions SO4dois- em torno da fédois+ são substituídos por moléculas HdoisO. Essas substituições perturbam os elétrons d ferro, forçando-os a passar por diferentes níveis de energia; que são responsáveis pelas mudanças de cor entre branco, verde azulado.
Acidez
Alguns ânions SO4dois- eles podem ser protonados como um produto do meio ácido. Como consequência, dentro dos cristais de FeSO47hdoisOu pode haver moléculas de HdoisSW4 se o pH for muito ácido; e, portanto, tocar esses lindos cristais em tais condições pode causar queimaduras graves..
Propriedades físicas e químicas
Nomes
Sulfato ferroso ou sulfato de ferro (II)
Fórmula molecular
-Sulfato ferroso anidro (FeSO4)
-Sulfato ferroso heptahidratado (FeSO4.7hdoisOU)
Peso molecular
Varia com o grau de hidratação do sulfato. Por exemplo, sulfato de ferro heptahidratado tem um peso molecular de 278,02 g / mol; enquanto o anidro tem um peso molecular de 151,91 g / mol.
Aparência física
Também varia com o grau de hidratação. Por exemplo, a forma anidra tem cristais ortorrômbicos brancos; enquanto na forma heptaidra, os cristais são monoclínicos azul esverdeados.
Odor
Banheiro
Densidade
O sulfato ferroso anidro é a forma de sal mais densa (3,65 g / cm3) A forma hepta-hidratada, por outro lado, é a menos densa (1,895 g / cm3).
Ponto de fusão
Da mesma forma, isso varia dependendo do grau de hidratação. A forma anidra tem ponto de fusão de 680ºC (1.856ºF, 973 K) e a forma heptahidratada, 60-64ºC (140-147ºF, 333-337 K).
Solubilidade em água
-Forma monohidratada: 44,69 g / 100 ml de água (77 ºC)
-Heptahidratado forma 51,35 g / 100 ml de água (54 ºC).
Solubilidade em álcool
Insolúvel.
Pressão de vapor
1,95 kPa (forma hepta-hidratada)
Índice de refração
1.591 (monohidrato) e 1.471 (heptahidratado).
Estabilidade
No ar, pode oxidar rapidamente e ficar coberto com uma cor amarelo-marrom, o que indica a presença do cátion Fe.3+. A taxa de oxidação é aumentada pela adição de álcali ou pela exposição à luz..
Decomposição
Quando aquecido até a decomposição, ele emite vapores tóxicos de dióxido de enxofre e trióxido de enxofre, deixando um óxido de ferro avermelhado como resíduo..
Reações
É um agente redutor que atua sobre o ácido nítrico reduzindo-o a monóxido de nitrogênio. Da mesma forma, reduz o cloro a cloreto, e as formas tóxicas do cromo presentes no cimento ao cromo (III), de menor toxidade.
Síntese
De lã de aço
O sulfato ferroso é produzido pela reação do aço (Fe) com ácido sulfúrico. No método descrito, segue-se o seguinte procedimento: o aço é utilizado na forma de lã de aço, previamente desengordurada com acetona..
A lã de aço é então colocada em um béquer de vidro e totalmente coberto com ácido sulfúrico 30-40%, permitindo que a digestão ácida ocorra por várias horas; até que a lã de aço desapareça. Mais lã de aço pode ser adicionada e o procedimento repetido várias vezes.
Os cristais verdes que podem ter se formado são redissolvidos usando água acidificada a pH 1-2 com ácido sulfúrico. Esta solução é filtrada em papel de filtro e o pH ajustado pela adição de carbonato de sódio. A solução é armazenada, para evitar seu contato com o oxigênio, e assim desestimular a oxidação do Fedois+ para a fé3+
Posteriormente, o filtrado é submetido à evaporação a uma temperatura entre 80-90 ºC. O procedimento é realizado em cápsulas de Pietri colocadas sobre uma placa de aquecimento. Em seguida, são coletados os cristais verdes formados, que podem ser levados a um dessecador para completar sua desidratação..
De pirita
O sulfato ferroso também é produzido pela oxidação da pirita (FeSdois).
2 FeSdois + 7 Odois + 2 hdoisO => 2 FeSO4 + 2 hdoisSW4
Riscos
Inalação de FeSO4 causa irritação no nariz, garganta e pulmões. O contato físico com este sal pode causar irritação na pele e nos olhos; Além disso, o contato prolongado com o último pode causar manchas acastanhadas e lesões oculares..
A ingestão repetida pode causar náuseas, vômitos, dor de estômago, constipação e movimentos intestinais irregulares..
Os sinais de envenenamento por sulfato ferroso incluem: fezes pretas ou com sangue; pele e unhas azuladas; mudanças no volume de urina excretada; desmaio; boca ou olhos secos; dor no peito; comer; dificuldade respiratória.
Além disso, podem ocorrer batimentos cardíacos rápidos e irregulares, aumento da sede e da fome, palidez incomum e falta de ar..
Coagulação alterada é uma indicação de envenenamento por sulfato ferroso, com prolongamento dos tempos de trombina, protrombina e tromboplastina parcial sendo observado..
Os estudos realizados sobre o efeito do sulfato ferroso em músculos isolados do coração de coelhos, permitiram observar que ele produziu uma redução na tensão máxima desenvolvida pelos músculos cardíacos estudados, bem como na velocidade máxima de desenvolvimento da tensão..
Formulários
Na agricultura
-É usado como pesticida para controlar a podridão e o apodrecimento de árvores frutíferas..
-É utilizado no tratamento da clorose, doença caracterizada pela coloração amarelada das folhas, causada pela alcalinidade dos solos..
-O sulfato ferroso controla a alcalinidade, diminuindo o pH dos solos.
- Remove musgo e condiciona o gramado.
Como reagente e na indústria
Dentro dos usos do FeSO4 como reagente e na indústria existem os seguintes:
-Reagente analítico
-Matéria-prima para obtenção de ferrita e óxido de ferro magnético
-Ingrediente para a produção do pigmento azul inorgânico
-Ácido nítrico, cloro e reagente redutor de cromo
-Na fabricação de outros sulfatos
-É utilizado nos banhos de galvanoplastia com ferro
-Preservativo de madeira
-Em gravuras de alumínio
-Análise qualitativa de nitratos (teste amarelo marrom por oxidação de Fedois+)
-Catalisador de polimerização
-É usado como um precursor para a síntese de outros ferros
-É usado industrialmente como fixador de manchas
-Na fabricação de corante de ferro
-Mordente na coloração de lã
-Para dar à madeira de bordo uma cor prateada
-Catalisador de ferro na reação de Fenton
Na medicina e para fortificação de alimentos
É utilizado no tratamento da anemia ferropriva, na dose de 150-300 mg de sulfato ferroso, três vezes ao dia, o que produz aumento perceptível na concentração de hemoglobina em uma semana de tratamento..
Também foi recomendado para uso em mulheres grávidas como um suplemento à dieta. O sulfato ferroso tem sido usado como adstringente na cicatrização de feridas em bovinos..
Outras
É utilizado no tratamento de efluentes por floculação e também na eliminação do fosfato dessas águas. O sulfato ferroso heptahidratado é utilizado na identificação dos tipos de fungos..
Referências
- CR Scientific. (s.f.). Preparação laboratorial de sulfato ferroso. Recuperado de: crscientific.com
- Werner H. Baur. (1964). Na química cristalina dos hidratos de sal. III. A determinação da estrutura cristalina de FeSO4.7hdoisOu (melanterita). Acta Cryst. doi.org/10.1107/S0365110X64003000
- PubChem. (2019). Sulfato ferroso heptahidratado. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Marks Lynn. (19 de dezembro de 2014). O que é sulfato ferroso (Feosol)? Cada saúde. Recuperado de: dailyhealth.com
- Wikipedia. (2019). Sulfato de ferro (II). Recuperado de: en.wikipedia.org



Ainda sem comentários