
Estrutura, propriedades, usos, produção do sulfato de sódio (Na2SO4)

O sulfato de sódio é um sal inorgânico cuja fórmula química é NadoisSW4. É constituído por um sólido branco, presente em três formas: anidro, o heptahidratado (pouco disponível) e o decahidrato (conhecido como sal de Glaubert); o último é a forma mais abundante de sulfato de sódio.
Sulfato de sódio decahidratado, NadoisSW410hdoisOu foi descoberto em 1625 por Glaubert na água de uma nascente, que o chamou de sal mirabilis (sal milagroso) devido às suas propriedades medicinais.

O sulfato de sódio tem inúmeras aplicações na indústria têxtil e de papel, bem como na fabricação de vidro. Seus usos são estendidos a aplicações térmicas, que incluem fornecimento de calor ambiente e resfriamento de laptop..
O sulfato de sódio é um composto de baixa toxicidade e suas ações nocivas são principalmente mecânicas e não químicas. Por razões cristalográficas, este sal, como sua contraparte de potássio, KdoisSW4, apresenta estruturas reticuladas e polimórficas.
Índice do artigo
- 1 Estrutura
- 1.1 Sal anidro
- 1.2 Sal desidratado
- 2 propriedades
- 2.1 Nomes
- 2,2 massa molar
- 2.3 Aparência física
- 2.4 Odor
- 2,5 Sabor
- 2.6 Densidade
- 2.7 Ponto de fusão
- 2.8 Ponto de ebulição
- 2.9 Solubilidade em água
- 2.10 Índice de refração
- 2.11 Estabilidade
- 2.12 Decomposição
- 2,13 pH
- 2.14 Reatividade
- 3 usos
- 3.1 Indústria de papel
- 3.2 Detergentes
- 3.3 Copos
- 3.4 Indústria Têxtil
- 3.5 Remédio
- 3.6 Agente de Secagem
- 3.7 Matéria-prima
- 4 Obtendo
- 4.1 Extração de mineração
- 4.2 Produção Química
- 5 riscos
- 6 referências
Estrutura
Sal anidro
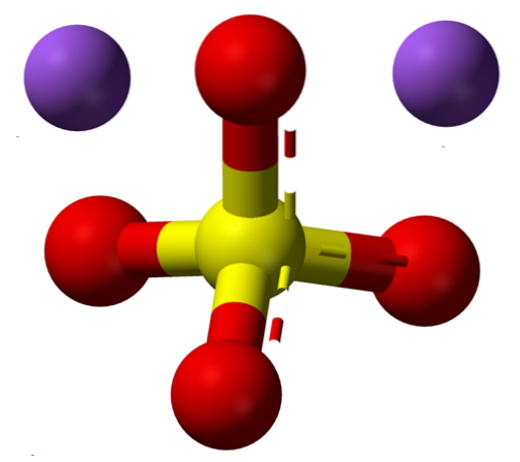
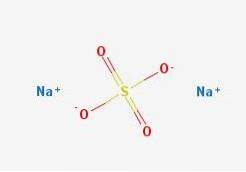
A fórmula NadoisSW4 indica imediatamente que os íons de Na nos cristais de sal+ Eu sou4dois- eles estão em uma proporção de 1: 2; ou seja, para cada dois Na cations+ há um ânion SO4dois- interagindo com eles por meio de atração eletrostática (imagem superior).
Claro, isso se aplica ao NadoisSW4 anidro, sem moléculas de água coordenadas com sódio nos cristais.
Apesar de ser um sal aparentemente simples, sua descrição é estruturalmente complexa. Então umadoisSW4 apresenta polimorfismo, possuindo até cinco fases cristalinas: I, II, III, IV e V, cujas temperaturas de transição são 180, 200, 228, 235 e 883 ºC, respectivamente.
Embora não haja referências para atestá-lo, o NadoisSW4Devo ser aquele com estrutura cristalina hexagonal, mais densa em relação ao Na ortorrômbicodoisSW4III, em cujos cristais Na+ forma tetraedro (NaO4) e octaedro (NaO6) coordenação; ou seja, pode ser rodeado por quatro ou seis ânions SO4dois-.
Sal desidratado
Enquanto isso, a estrutura cristalina monoclínica de seu hidrato mais importante, o NadoisSW410hdoisOu é mais simples. Nele, são praticamente as moléculas de água que interagem ou se coordenam com o Na+ no octaedro Na (HdoisOU)6+, com o SO4dois- apenas fornecendo estabilidade suficiente ao cristal para que ele exista na fase sólida.
Porém, seu ponto de fusão (32,38 ºC) muito inferior ao do sal anidro (884 ºC) mostra como as moléculas de água e suas ligações de hidrogênio enfraquecem as interações iônicas mais fortes no NadoisSW4.
Propriedades
Nomes
-Sulfato de sódio (IUPAC)
-Sal de Glauber (decahidrato)
-Sal Milagroso (Decahidrato)
-Sulfato dissódico.
Massa molar
142,04 g / mol (anidro)
322,20 g / mol (decahidrato)
Aparência física
Sólido cristalino higroscópico branco
Odor
Banheiro
Gosto
Amargo e salgado
Densidade
2.664 g / cm3 (anidro)
1.464 g / cm3 (decahidrato)
Observe como as moléculas de água dentro dos cristais fazem com que eles se expandam e, portanto, diminuam sua densidade..
Ponto de fusão
884 ºC (anidro)
32,38 ºC (deca-hidratado)
Ponto de ebulição
1.429 ºC (anidro)
Solubilidade em água
4,76 g / 100 ml (0 ºC)
13,9 g / 100 ml (20 ° C)
42,7 g / 100 ml (100 ° C)
Todos os valores de solubilidade correspondem ao sal anidro, que é bastante solúvel em água em todas as temperaturas..
A solubilidade aumenta abruptamente entre 0ºC e 38,34ºC, observando-se que nesta faixa de temperatura a solubilidade aumenta mais de 10 vezes. Porém, a partir de 32,38 ºC, a solubilidade é independente da temperatura..
Acontece que a uma temperatura de 32,8 ºC, o sulfato de sódio deca-hidratado se dissolve em sua própria água cristalina. Um equilíbrio é assim alcançado entre o sal deca-hidratado, o sal anidro e a solução saturada de sulfato de sódio..
Enquanto a condição trifásica for mantida, a temperatura permanecerá constante, o que permite que a temperatura dos termômetros seja calibrada.
Por outro lado, as solubilidades para o sal hepta-hidratado são:
19,5 g / 100 ml (0 ºC)
44,0 g / 100 ml (20 ° C)
Observe que a 20 ° C o sal hepta-hidratado é três vezes mais solúvel que o anidro..
Índice de refração
1.468 (anidro)
1,394 (decahidrato)
Estabilidade
Estável nas condições de armazenamento recomendadas. Incompatível com ácidos e bases fortes, alumínio e magnésio.
Decomposição
Quando aquecido até a decomposição, emite uma fumaça tóxica de óxido sulfuroso e óxido de sódio..
pH
Uma solução aquosa a 5% tem um pH de 7.
Reatividade
O sulfato de sódio se dissocia em solução aquosa em 2 Na+ Eu sou4dois-, que permite que o íon sulfato se combine com o Badois+ para precipitar o sulfato de bário. Praticamente ajuda a deslocar íons de bário de amostras de água.
O sulfato de sódio é convertido em sulfeto de sódio reagindo a temperaturas elevadas com carvão:
N / DdoisSW4 + 2 C => NadoisS + 2 COdois
Sal de Glaubert, NaSO4.10hdoisOu reage com carbonato de potássio para produzir carbonato de sódio.
Formulários
Indústria de papel
O sulfato de sódio é utilizado na fabricação de polpa de papel. É utilizado na produção de papel Kraft, que não contém lignina ou é submetido ao processo de branqueamento, o que lhe confere grande resistência. Além disso, é utilizado na fabricação de papelão.
Detergentes
Usado como um material de enchimento para detergentes domésticos sintéticos, sendo adicionado ao detergente para reduzir a tensão superficial.
Copos
É usado na fabricação de vidro para reduzir ou eliminar a presença de pequenas bolhas de ar no vidro fundido. Além disso, elimina a formação de escória durante o processo de refino do vidro fundido.
Indústria têxtil
O sulfato de sódio é utilizado como mordente, pois facilita a interação dos corantes com as fibras dos tecidos. O sulfato de sódio decahidratado é usado no teste de tintura.
Além disso, o sulfato de sódio é usado como diluente de tinta e agente auxiliar de impressão de tinta; como corantes diretos, corantes de enxofre e outros agentes que promovem a mancha de algodão. Também é usado como agente retardador para tinturas diretas de seda.
Medicamento
O sulfato de sódio deca-hidratado é usado como laxante, pois é pouco absorvido no intestino e, portanto, permanece na luz do intestino causando aumento de volume. Isso estimula o aumento das contrações peristálticas que induzem a expulsão do conteúdo intestinal..
O sulfato de sódio é um antídoto para controlar o envenenamento por bário e sal de chumbo. O sal de Glaubert é eficaz na eliminação de certos medicamentos excessivamente ingeridos; por exemplo, paracetamol (acetoaminofeno).
Além disso, é usado para fornecer eletrólitos deficientes presentes em soluções isoosmóticas..
Agente de secagem
O sulfato de sódio, sendo um reagente inerte, é usado para remover a água de soluções de compostos orgânicos..
Matéria prima
O sulfato de sódio é usado como matéria-prima para a produção de inúmeras substâncias, incluindo: sulfeto de sódio, carbonato de sódio e sulfato de amônio.
Obtendo
O sulfato de sódio é obtido por extração mineral e por reações químicas.
Extração de mineração
Existem três minérios ou minerais que são explorados com rendimento comercial: a tenardita (NadoisSW4), a mirabilita (NadoisSW410hdoisO) e glaubarita (NadoisSW4·Caso4).
Na Espanha, os depósitos de tenardita e mirabilita são explorados por mineração subterrânea de galerias e pilares. Já a glauberita é obtida a céu aberto, por meio de grandes jangadas que são colocadas no depósito mineral..
O terreno é preparado com jateamento de baixa intensidade para produzir uma porosidade que permite a lixiviação do sulfato de sódio. A fase de produção ocorre com a irrigação por aspersão com água doce da glauberita, cuja lixiviação se espalha para baixo..
A salmoura de sulfato de sódio é coletada, deixando o resíduo de sulfato de cálcio como enchimento..
Produção química
O sulfato de sódio é obtido durante a produção de ácido clorídrico por dois processos: o processo Mannheim e o processo Hardgreaves.
Processo Mannheim
É realizado em grandes fornos siderúrgicos e com uma plataforma de reação de aço de 6 m. A reação ocorre entre o cloreto de sódio e o ácido sulfúrico:
2 NaCl + HdoisSW4 => 2 HCl + NadoisSW4
Processo Hardgreaves
Envolve a reação de cloreto de sódio, óxido de enxofre, oxigênio e água:
4 NaCl + 2 SOdois + OUdois + 2 hdoisO => 4 HCl + NadoisSW4
Outras
O sulfato de sódio é produzido na reação de neutralização entre o hidróxido de sódio e o ácido sulfúrico:
2 NaOH + HdoisSW4 => NadoisSW4 + HdoisOU
O sulfato de sódio é um subproduto da produção de vários compostos. É extraído dos resíduos líquidos descartados durante a produção de viscose e celofane. Também na produção de dicromato de sódio, fenóis, ácido bórico e carbamato de lítio.
Riscos
O sulfato de sódio é considerado um composto de baixa toxicidade. No entanto, pode causar alguns danos à pessoa que o usa de forma inadequada..
Por exemplo, pode causar irritação nos olhos, vermelhidão e dor ao contato. Na pele, pode causar irritação e alergia em algumas pessoas. Sua ingestão pode causar irritação do trato digestivo com náuseas, vômitos e diarréia. E, finalmente, sua inalação produz irritação no trato respiratório.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Wikipedia. (2019). Sulfato de sódio. Recuperado de: en.wikipedia.org
- Centro Nacional de Informações sobre Biotecnologia. (2019). Sulfato de sódio. Banco de dados PubChem. CID = 24436. Recuperado de: pubchem.ncbi.nlm.nih.gov
- B. N. Mehrotra. (1978). A estrutura cristalina do NadoisSW4III. Recuperado de: rruff-2.geo.arizona.edu
- Glauberite-Tenardita (sulfato de sódio). [PDF]. Recuperado de: igme.es



Ainda sem comentários