
Fórmula, propriedades e usos do tiossulfato de sódio (Na2S2O3)
O tiossulfato de sódio ou hipossulfito de sódio (NadoisSdoisOU3) É um sal inorgânico importante com vários usos médicos. Também está disponível como seu sal pentahidratado (NadoisSdoisOU3.5hdoisOU).
É um composto iônico formado por dois cátions de sódio (Na+) e o ânion tiossulfato carregado negativamente (SdoisOU3-), em que o átomo de enxofre central está ligado a três átomos de oxigênio e a outro átomo de enxofre (daí o prefixo tio), por meio de ligações simples e duplas com caráter de ressonância. O sólido existe em uma estrutura de cristal monoclínica.
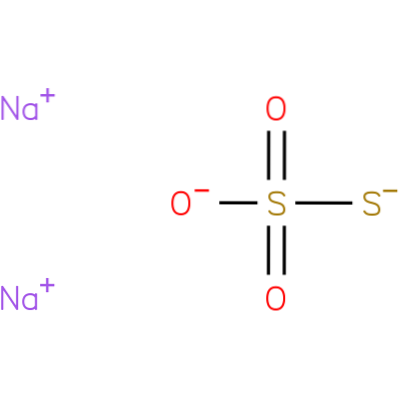
O tiossulfato de sódio pode ser preparado aquecendo o enxofre com uma solução aquosa de sulfito de sódio ou uma solução aquosa de hidróxido de sódio..
6 NaOH + 4S → NadoisSdoisOU3 + 2NadoisS + 3HdoisOU
É um medicamento que está na Lista de Medicamentos Essenciais da Organização Mundial de Saúde, os medicamentos mais eficazes e seguros que são necessários em um sistema de saúde (fórmula de tiossulfato de sódio, S.F.).
Índice do artigo
- 1 Propriedades físicas e químicas
- 2 Reatividade e perigos
- 3 usos
- 3.1 Medicina
- 3.2 Iodometria
- 3.3 Decloração de água
- 3.4 Mineração de ouro
- 4 referências
Propriedades físicas e químicas
O tiossulfato de sódio tem um peso molecular de 158,11 g / mol para sua forma anidra e 248,18 g / mol para a forma penta-hidratada. Além disso, tem uma densidade de 1.667 g / ml (National Center for Biotechnology Information., 2017).
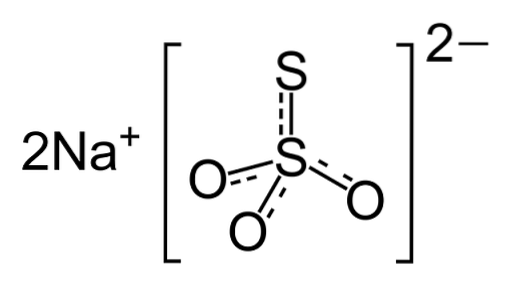
O tiossulfato de sódio são cristais monoclínicos incolores sem um aroma característico. O referido sólido é eflorescente, o que significa que pode ser reduzido a pó por si só pela perda de água de cristalização quando exposto ao ar. Sua aparência é mostrada na figura 2.

O composto tem um ponto de fusão de 48 ° C para a forma penta-hidratada e a partir de 100 ° C começa a se decompor. Então umadoisSdoisOU3 É muito solúvel em água, podendo dissolver 70 gramas por 100 mililitros de solvente. O composto é praticamente insolúvel em etanol (Royal Society of Chemistry, 2015).
O tiossulfato de sódio é um sal neutro que se dissocia prontamente em água para dar íons de sódio e tiossulfato. N / DdoisSdoisOU3 É um sólido estável em condições normais, mas se decompõe ao aquecer para dar sulfato de sódio e polissulfeto de sódio:
4NadoisSdoisOU3 → 3NadoisSW4 + N / DdoisS5
Ele também se decompõe quando tratado com ácidos diluídos para dar enxofre e dióxido de enxofre (chamada de reação do relógio):
N / DdoisSdoisOU3 + 2HCl → 2NaCl + S + SOdois + HdoisOU
Reage estequiometricamente (em quantidades equimolares) com soluções aquosas de iodo, tornando-se amplamente utilizado em laboratórios para titulações à base de iodo.
Reatividade e perigos

O tiossulfato de sódio não é um material tóxico e é usado para fins médicos. No entanto, quando decomposto, produz vapores tóxicos de óxido de enxofre, que podem causar irritação nos olhos, pele e membranas mucosas..
O composto pode irritar os olhos, a pele e o trato respiratório. A substância é tóxica para os pulmões e as membranas mucosas. A exposição repetida ou prolongada à substância pode causar danos a esses órgãos..
Se o composto entrar em contato com os olhos, as lentes de contato devem ser verificadas e removidas. Os olhos devem ser lavados imediatamente com bastante água por pelo menos 15 minutos com água fria.
Em caso de contato com a pele, a área afetada deve ser enxaguada imediatamente com água em abundância por pelo menos 15 minutos, enquanto se remove roupas e calçados contaminados. Cubra a pele irritada com um emoliente. Lave roupas e sapatos antes de reutilizá-los. Se o contato for severo, lave com sabonete desinfetante e cubra a pele contaminada com um creme antibacteriano.
Em caso de inalação, a vítima deve ser removida para local fresco. Se não estiver respirando, é administrada respiração artificial. Se a respiração estiver difícil, dê oxigênio.
Se o composto for ingerido, o vômito não deve ser induzido, a menos que seja orientado por um médico. Afrouxe roupas apertadas, como colarinho de camisa, cinto ou gravata.
Em todos os casos, deve-se obter atenção médica imediata. (Folha de dados de segurança de material tiossulfato de sódio anidro, 2013).
Formulários
Medicamento
O tiossulfato de sódio pode ser usado para diminuir alguns dos efeitos colaterais da cisplatina (um medicamento contra o câncer). É usado no tratamento de extravasamentos durante a quimioterapia. O tiossulfato de sódio evita a alquilação e a destruição do tecido, fornecendo um substrato para agentes alquilantes que invadiram os tecidos subcutâneos.
Também é usado com outro medicamento no tratamento de emergência de envenenamento por cianeto (U.S. National Library of Medicine, S.F.).
Nesse tratamento, o nitrito de sódio é injetado por via intravenosa para produzir hemoglobina que se combina com o íon cianeto, convertendo-o temporariamente na forma cianmetoglobina. Posteriormente, o tiossulfato de sódio é injetado.
O tiossulfato serve como substrato para a enzima rodanase, que catalisa a conversão do cianeto no tiocianato muito menos tóxico, que é excretado na urina (HSDB: SODIUM THIOSULFATE, 2003).
O tiossulfato de sódio também é usado como tratamento para a calcifilaxia em pessoas em hemodiálise com doença renal em estágio terminal. Aparentemente, existe um fenômeno não totalmente compreendido, pelo qual isso causa acidose metabólica grave em alguns pacientes..
Iodometria
O tiossulfato de sódio reage estequiometricamente com o iodo para dar iodeto de acordo com a reação:
2NadoisSdoisOU3 + I2 → S4OU62− + 2I-
Esta propriedade faz com que o composto seja usado como titulante na determinação de iodo..
Esse uso específico pode ser estabelecido para medir o conteúdo de oxigênio da água por meio de uma longa série de reações no teste de Winkler para oxigênio dissolvido..
Também é usado na estimativa volumétrica das concentrações de certos compostos em solução (peróxido de hidrogênio, por exemplo) e na estimativa do teor de cloro em alvejantes comerciais em pó e água..
Decloração de água
El tiosulfato de sodio se utiliza para desclorar el agua, incluyendo la reducción de los niveles de cloro para su uso en acuarios y piscinas y spas y dentro de las plantas de tratamiento de agua para tratar el agua de lavado posterior establecida antes de su liberación en os rios.
A reação de redução é análoga à reação de redução do iodo, o tiossulfato reduz o hipoclorito (ingrediente ativo na lixívia) e, ao fazê-lo, oxida-se em sulfato. A reação completa é:
4NaClO + NadoisSdoisOU3 + 2NaOH → 4NaCl + 2NadoisSW4 + HdoisOU
Mineração de ouro
O tiossulfato de sódio é um componente usado como agente de lixiviação alternativo ao cianeto para extração de ouro. No entanto, forma um forte complexo solúvel com os íons ouro (I), [Au (SdoisOU3)dois]3-.
A vantagem desta abordagem é que o tiossulfato é essencialmente não tóxico e que os tipos de minerais que são refratários à cianetação do ouro podem ser lixiviados por tiossulfato (M.G Aylmore, 2001).
Referências
- EMBL-EBI. (2016, 1º de junho). tiossulfato de sódio. Recuperado de ebi.ac.uk: ebi.ac.uk.
- HSDB: TIOSULFATO DE SÓDIO. (2003, 3 de maio). Recuperado de toxnet: toxnet.nlm.nih.gov.
- G. Aylmore, D. M. (2001). Lixiviação de tiossulfato de revisão de ouro-A. Minerals Engineering Volume 14, Issue 2, 135-174. sciencedirect.com.
- Folha de Dados de Segurança de Material Tiossulfato de sódio anidro. (2013, 21 de maio). Recuperado de sciencelab.com.
- National Center for Biotechnology Information… (2017, 18 de março). PubChem Compound Database; CID = 24477. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Tiossulfato de sódio. Recuperado de chemspider.com.
- Fórmula de tiossulfato de sódio. (S.F.). Recuperado de softschools: softschools.com.
- S. Biblioteca Nacional de Medicina. (S.F.). Tiossulfato de sódio (em uma veia). Recuperado de ncbi.nlm.nih.gov.



Ainda sem comentários