
Estrutura Titina, funções e patologias relacionadas
Titina é o termo usado para descrever um par de cadeias polipeptídicas gigantes que constituem a terceira proteína mais abundante nos sarcômeros de uma ampla gama de músculos esqueléticos e cardíacos.
A titina é uma das maiores proteínas conhecidas em termos de número de resíduos de aminoácidos e, portanto, em termos de peso molecular. Esta proteína também é conhecida como conectando e está presente em vertebrados e invertebrados.
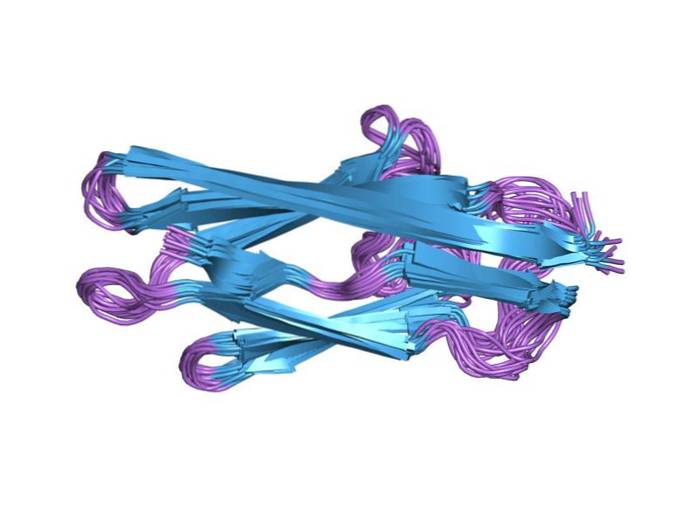
Foi descrito com este nome (conectina) pela primeira vez em 1977 e em 1979 foi definido como a banda dupla na parte superior de um gel de eletroforese em gel de poliacrilamida sob condições desnaturantes (com dodecil sulfato de sódio). Em 1989 sua localização foi estabelecida por microscopia imunoeletrônica.
Junto com outra grande proteína, a nebulina, a titina é um dos principais componentes da rede elástica do citoesqueleto da célula muscular que coexiste com os filamentos grossos (miosina) e os filamentos finos (actina) dentro dos sarcômeros; tanto que é conhecido como o terceiro sistema filamentar das fibras musculares.
Os filamentos grossos e finos são responsáveis pela geração da força ativa, enquanto os filamentos de titina determinam a viscoelasticidade dos sarcômeros..
Um sarcômero é a unidade de repetição das miofibrilas (fibras musculares). Tem aproximadamente 2μm de comprimento e é delimitado por "placas" ou linhas chamadas linhas Z, que segmentam cada miofibrila em fragmentos estriados de tamanho definido.
As moléculas de titina se agrupam em filamentos filamentosos extremamente longos, flexíveis, finos e extensíveis. A titina é responsável pela elasticidade do músculo esquelético e acredita-se que funcione como uma estrutura molecular que especifica a montagem correta dos sarcômeros nas miofibrilas..
Índice do artigo
- 1 Estrutura
- 2 funções
- 2.1 Outras funções
- 3 patologias relacionadas
- 4 referências
Estrutura
Em vertebrados, a titina tem cerca de 27.000 resíduos de aminoácidos e um peso molecular de cerca de 3 MDa (3.000 kDa). É composto por duas cadeias polipeptídicas conhecidas como T1 e T2, que possuem composições químicas semelhantes e propriedades antigênicas semelhantes..
No músculo dos invertebrados estão os "minititinas”De entre 0,7 e 1,2MDa de peso molecular. Este grupo de proteínas inclui a proteína "Twitchina" a partir de Caenorhabditis elegans e proteína "Projetando" encontrado no gênero Drosófila.
A titina de vertebrados é uma proteína modular composta principalmente de imunoglobulina e domínios semelhantes à fibronectina III (FNIII-Como) organizados em lote. Possui uma região elástica rica em resíduos de prolina, ácido glutâmico, valina e lisina, conhecida como domínio PEVK, e outro domínio serina quinase em sua extremidade carboxila terminal..
Cada um dos domínios tem aproximadamente 100 aminoácidos de comprimento e são conhecidos como titina de classe I (o domínio III do tipo fibronectina) e titina de classe II (o domínio do tipo imunoglobulina). Ambos os domínios dobram-se em estruturas "sanduíche" de 4 nm de comprimento compostas por folhas β antiparalelas..
A molécula de conectina cardíaca contém 132 motivos repetidos do domínio de imunoglobulina e 112 motivos repetidos do domínio semelhante à fibronectina III..
O gene codificador dessas proteínas (TTN) é o "campeão" dos introns, pois tem quase 180 deles dentro.
Os transcritos das subunidades são processados diferencialmente, especialmente as regiões codificantes da imunoglobulina (Ig) e domínios semelhantes a PEVK, que dão origem a isoformas com diferentes propriedades extensíveis..
Características
A função da titina nos sarcômeros depende de sua associação com diferentes estruturas: sua extremidade C-terminal está ancorada na linha M, enquanto a extremidade N-terminal de cada titina está ancorada na linha Z.
As proteínas nebulina e titina atuam como "réguas moleculares" que regulam o comprimento dos filamentos grossos e finos, respectivamente. A titina, como mencionado, se estende do disco Z para além da linha M, no centro do sarcômero, e regula seu comprimento, evitando o estiramento excessivo da fibra muscular..
Foi demonstrado que o dobramento e desdobramento da titina auxiliam no processo de contração muscular, ou seja, gera o trabalho mecânico que atinge o encurtamento ou extensão dos sarcômeros; enquanto as fibras grossas e finas são os motores moleculares do movimento.
A titina participa da manutenção dos filamentos grossos do centro do sarcômero e suas fibras são responsáveis pela geração de tensão passiva durante o alongamento dos sarcômeros..
Outras funções
Além de sua participação na geração da força viscoelástica, a titina tem outras funções, entre as quais:
-Participação em eventos de sinalização mecânico-química por meio de sua associação com outras proteínas sarcoméricas e não sarcômeras
-Ativação do aparelho contrátil dependente do comprimento
-Montagem Sarcomere
-Contribuição para a estrutura e função do citoesqueleto em vertebrados, entre outros.
Certos estudos demonstraram que em células humanas e embriões de Drosófila, a titina tem outra função como proteína cromossômica. As propriedades elásticas da proteína purificada correspondem perfeitamente às propriedades elásticas dos cromossomos das células vivas e dos cromossomos reunidos. em vitro.
A participação dessa proteína na compactação dos cromossomos foi demonstrada graças a experimentos de mutagênese dirigida ao local do gene que a codifica, resultando em defeitos musculares e cromossômicos..
Lange et al., Em 2005, demonstraram que o domínio da titina quinase tem relação com o complexo sistema de expressão de genes musculares, fato demonstrado pela mutação desse domínio que causa doenças musculares hereditárias.
Patologias relacionadas
Algumas doenças cardíacas estão associadas a alterações na elasticidade da titina. Essas alterações afetam muito a extensibilidade e a rigidez diastólica passiva do miocárdio e, presumivelmente, a mecanossensibilidade..
The Gen TTN foi identificado como um dos principais genes envolvidos em doenças humanas, portanto, as propriedades e funções da proteína cardíaca foram amplamente estudadas nos últimos anos.
A cardiomiopatia dilatada e a cardiomiopatia hipertrófica também são produto da mutação de vários genes, incluindo o gene TTN.
Referências
- Despopoulos, A., & Silbernagl, S. (2003). Atlas colorido de fisiologia (5ª ed.). Nova York: Thieme.
- Herman, D., Lam, L., Taylor, M., Wang, L., Teekakirikul, P., Christodoulou, D.,… Seidman, C. E. (2012). Truncamentos de titina causando cardiomiopatia dilatada. O novo jornal inglês de medicina, 366(7), 619-628.
- Keller, T. (1995). Estrutura e função da titina e nebulina. Opinião Atual em Biologia, 7, 32-38.
- Lange, S., Lange, S., Xiang, F., Yakovenko, A., Vihola, A., Hackman, P.,… Gautel, M. (2005). O domínio quinase da titina controla a expressão do gene muscular e a renovação de proteínas. Ciência, 1599-1603.
- Linke, W. A., & Hamdani, N. (2014). Negócios gigantescos: propriedades e funções de titina através de espessas e finas. Circulation Research, 114, 1052-1068.
- Machado, C., & Andrew, D. J. (2000). D-TITIN: uma proteína gigante com funções duplas em cromossomos e músculos. The Journal of Cell Biology, 151(3), 639-651.
- Maruyama, K. (1997). Proteína elástica gigante de músculo. The FASEB Journal, onze, 341-345.
- Nelson, D. L., & Cox, M. M. (2009). Princípios de Bioquímica de Lehninger. Edições Omega (5ª ed.).
- Rivas-Pardo, J., Eckels, E., Popa, I., Kosuri, P., Linke, W., & Fernández, J. (2016). Trabalho realizado por Titin Protein Folding auxilia na contração muscular. Relatórios de Célula, 14, 1339-1347.
- Trinick, J. (1994). Titina e nebulina: governantes de proteína no músculo? Tendências em Ciências Bioquímicas, 19, 405-410.
- Tskhovrebova, L., & Trinick, J. (2003). Titin: propriedades e relações familiares. Nature Reviews, 4, 679-6889.
- Wang, K., Ramirez-Mitchell, R., & Palter, D. (1984). A titina é uma proteína miofibrilar extraordinariamente longa, flexível e delgada. Proc. Natl. Acad. Sci., 81, 3685-3689.


Ainda sem comentários