
Transmitância o que é, diagrama de energia molecular e exercício
O transmitância Ótico é o quociente entre a intensidade da luz emergente e a intensidade da luz incidente em uma amostra de solução translúcida que foi iluminada com luz monocromática..
O processo físico de passagem da luz através de uma amostra é denominado transmissão de luz e a transmitância é uma medida de transmissão de luz. A transmitância é um valor importante para determinar a concentração de uma amostra que geralmente está dissolvida em um solvente como água ou álcool, entre outros..
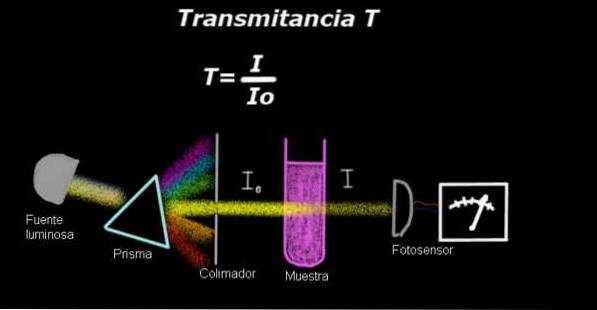
Um eletrofotômetro mede uma corrente proporcional à intensidade da luz que incide sobre sua superfície. Para calcular a transmitância, o sinal de intensidade correspondente ao solvente sozinho é geralmente medido primeiro e este resultado é registrado como Io.
Em seguida, a amostra dissolvida é colocada no solvente com as mesmas condições de iluminação e o sinal medido pelo eletrofotômetro é indicado como eu, então a transmitância é calculada de acordo com a seguinte fórmula:
T = I / Iou
Deve-se notar que a transmitância é uma grandeza adimensional, pois é uma medida da intensidade luminosa de uma amostra em relação à intensidade da transmissão do solvente..
Índice do artigo
- 1 O que é transmitância?
- 1.1 Absorção de luz em um meio
- 1.2 Teoria molecular de absorção de luz
- 2 Diagrama de energia molecular
- 2.1 Fatores dos quais a transmitância depende
- 3 Exercício resolvido
- 3.1 Exercício 1
- 4 referências
O que é transmitância?
Absorção de luz em um meio
Quando a luz passa por uma amostra, parte da energia da luz é absorvida pelas moléculas. A transmitância é a medida macroscópica de um fenômeno que ocorre em nível molecular ou atômico.
A luz é uma onda eletromagnética, a energia que ela carrega está no campo elétrico e magnético da onda. Esses campos oscilantes interagem com as moléculas de uma substância.
A energia transportada pela onda depende de sua frequência. A luz monocromática tem uma única frequência, enquanto a luz branca tem uma faixa ou espectro de frequências..
Todas as frequências de uma onda eletromagnética viajam no vácuo à mesma velocidade de 300.000 km / s. Se denotarmos por c na velocidade da luz no vácuo, a razão de frequência F e comprimento de onda λ isso é:
c = λ⋅f
o que c é uma constante em cada frequência corresponde ao seu respectivo comprimento de onda.
Para medir a transmitância de uma substância, são utilizadas as regiões do espectro eletromagnético visível (380 nm a 780 nm), a região ultravioleta (180 a 380 nm) e a região do infravermelho (780 nm a 5600 nm).
A velocidade de propagação da luz em um meio material depende da frequência e é menor que c. Isso explica a dispersão em um prisma com o qual as frequências que compõem a luz branca podem ser separadas..
Teoria molecular da absorção de luz
Átomos e moléculas têm níveis de energia quantizados. À temperatura ambiente, as moléculas estão em seus níveis de energia mais baixos.
O fóton é a partícula quântica associada à onda eletromagnética. A energia do fóton também é quantizada, ou seja, um fóton de frequência F tem energia fornecida por:
E = h⋅f
Onde h é a constante de Planck cujo valor é 6,62 × 10 ^ -34 J⋅s.
A luz monocromática é um feixe de fótons de uma determinada frequência e energia.
As moléculas absorvem fótons quando sua energia corresponde à diferença necessária para levar a molécula a um nível de energia mais alto.
As transições de energia por absorção de fótons em moléculas podem ser de vários tipos:
1- Transições eletrônicas, quando os elétrons dos orbitais moleculares vão para orbitais de maior energia. Essas transições geralmente ocorrem nas faixas do visível e ultravioleta e são as mais importantes.
2- Transições vibracionais, as energias de ligação molecular também são quantizadas e quando um fóton da região do infravermelho é absorvido, a molécula vai para um estado de maior energia vibracional.
3- Transições rotacionais, quando a absorção de um fóton leva a molécula a um estado rotacional de maior energia.
Diagrama de energia molecular
Essas transições são mais bem compreendidas com um diagrama de energia molecular mostrado na Figura 2:
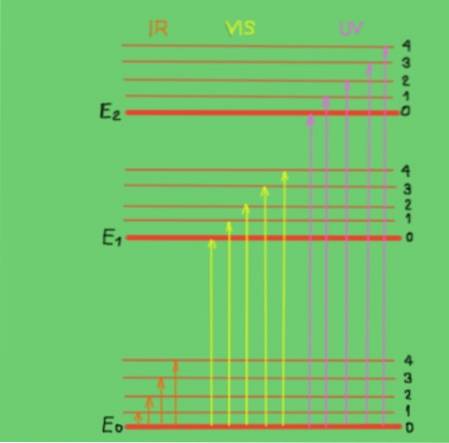
No diagrama, as linhas horizontais representam diferentes níveis de energia molecular. A linha E0 é o nível de energia fundamental ou inferior. Os níveis E1 e E2 são níveis excitados de energia superior. Os níveis E0, E1, E2 correspondem aos estados eletrônicos da molécula.
Os subníveis 1, 2, 3, 4 dentro de cada nível eletrônico correspondem aos diferentes estados vibracionais correspondentes a cada nível eletrônico. Cada um desses níveis tem subdivisões mais finas que não são mostradas como correspondendo aos estados rotacionais associados a cada nível vibracional..
O diagrama mostra setas verticais que representam a energia dos fótons nas faixas infravermelha, visível e ultravioleta. Como pode ser visto, os fótons infravermelhos não têm energia suficiente para promover as transições eletrônicas, ao contrário da radiação visível e ultravioleta..
Quando os fótons incidentes de um feixe monocromático coincidem em energia (ou frequência) com a diferença de energia entre os estados de energia molecular, ocorre a absorção dos fótons..
Fatores dos quais a transmitância depende
De acordo com o que foi dito na seção anterior, a transmitância passará então a depender de vários fatores, entre os quais podemos citar:
1- A frequência com que a amostra é iluminada.
2- O tipo de moléculas a serem analisadas.
3- A concentração da solução.
4- O comprimento do caminho percorrido pelo feixe de luz.
Os dados experimentais indicam que a transmitância T diminui exponencialmente com a concentração C e com o comprimento eu do caminho óptico:
T = 10-a⋅C⋅L
Na expressão acima para é uma constante que depende da frequência e do tipo de substância.
Exercício resolvido
Exercício 1
Uma amostra padrão de uma determinada substância tem uma concentração de 150 micromoles por litro (μM). Quando sua transmitância é medida com luz de 525 nm, obtém-se uma transmitância de 0,4..
Outra amostra da mesma substância, mas de concentração desconhecida, tem transmitância de 0,5, quando medida na mesma frequência e com a mesma espessura óptica..
Calcule a concentração da segunda amostra.
Responder
A transmitância T decai exponencialmente com a concentração C:
T = 10-b⋅L
Se o logaritmo da igualdade anterior for assumido, ele permanece:
log T = -b⋅C
Dividindo membro por membro a igualdade anterior aplicada a cada amostra e resolvendo a concentração desconhecida permanece:
C2 = C1⋅ (log T2 / log T1)
C2 = 150μM⋅ (log 0,5 / log 0,4) = 150μM⋅ (-0,3010 / -0,3979) = 113,5μM
Referências
- Atkins, P. 1999. Physical Chemistry. Edições Omega. 460-462.
- A guia. Transmitância e absorbância. Recuperado de: quimica.laguia2000.com
- Toxicologia Ambiental. Transmitância, absorbância e lei de Lambert. Recuperado de: repositorio.innovacionumh.es
- Aventura física. Absorbância e transmitância. Recuperado de: rpfisica.blogspot.com
- Espectofotometria. Recuperado de: chem.libretexts.org
- Toxicologia Ambiental. Transmitância, absorbância e lei de Lambert. Recuperado de: repositorio.innovacionumh.es
- Wikipedia. Transmitância. Recuperado de: wikipedia.com
- Wikipedia. Espectrofotometria. Recuperado de: wikipedia.com



Ainda sem comentários