
Tripolifosfato de sódio (Na5P3O10) estrutura, propriedades, usos, impacto
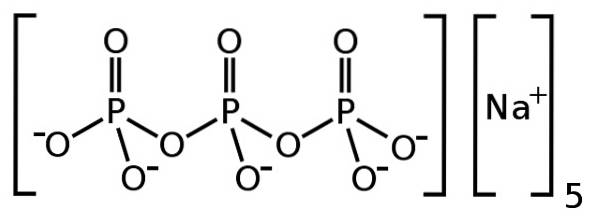
O tripolifosfato de sódio é um composto inorgânico formado por cinco íons sódio Na+ e um íon tripolifosfato P3OU105-. Sua fórmula química é Na5P3OU10. O íon tripolifosfato contém três unidades de fosfato ligadas entre si e é o que é chamado de fosfato condensado.
O ânion P tripolifosfato3OU105- tem a capacidade de prender íons como cálcio Cadois+ e magnésio Mgdois+, Portanto, o tripolifosfato de sódio é utilizado como auxiliar em detergentes para que funcionem melhor em determinados tipos de água..
O tripolifosfato de sódio também é usado como fonte de fósforo na dieta de animais que pastam e no tratamento de algumas doenças de outros tipos de animais. Também é usado para engrossar e dar textura a alguns alimentos processados, como cremes, pudins e queijos..
Na indústria agrícola, é usado em fertilizantes granulados para evitar que grudem uns nos outros e fiquem soltos..
Embora tenha havido discussões sobre o impacto ambiental do tripolifosfato de sódio adicionado aos detergentes, atualmente estima-se que ele não contribui de forma significativa para causar danos ao meio ambiente, pelo menos através dos detergentes..
Índice do artigo
- 1 Estrutura química
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Densidade
- 3.5 Solubilidade
- 3,6 pH
- 3.7 Propriedades químicas
- 3.8 Outras propriedades
- 4 Obtendo
- 5 usos
- 5.1 Em detergentes
- 5.2 Para uso veterinário
- 5.3 Na medicina
- 5.4 Na indústria de alimentos
- 5.5 Outros usos
- 6 Impacto ambiental
- 7 riscos
- 8 referências
Estrutura química
O tripolifosfato de sódio é um dos chamados fosfatos condensados porque consiste em várias unidades de fosfato ligadas entre si. Neste caso, o íon tripolifosfato é um fosfato condensado linear, pois possui uma estrutura semelhante a uma cadeia linear, com ligações fósforo-oxigênio-fósforo (P-O-P).
Nomenclatura
- Tripolifosfato de sódio
- Trifosfato de sódio
- Trifosfato pentassódico
- STPP (acrônimo do inglês TriPolifosfato de Sódio)
Propriedades
Estado físico
Sólido cristalino incolor a branco.
Peso molecular
367,86 g / mol.
Ponto de fusão
622 ° C.
Densidade
2,52 g / cm3
Solubilidade
Solúvel em água: 20 g / 100 mL a 25 ° C e 86,5 g / 100 mL a 100 ° C.
pH
Uma solução a 1% de tripolifosfato de sódio tem um pH de 9,7-9,8.
Propriedades quimicas
É um agente sequestrante de íons, ou seja, pode prender íons e permanecer ligado a eles. Forma complexos com muitos metais.
Se uma solução de tripolifosfato de sódio for aquecida por um longo tempo, ela tende a se converter em ortofosfato de sódio Na.3PO4.
Outras propriedades
É ligeiramente higroscópico. Forma hidratos estáveis, ou seja, compostos que possuem moléculas de água ligadas (sem ter reagido com elas) de fórmula Na5P3OU10.nHdoisOu onde n pode estar entre 1 e 6.
Segundo algumas fontes, uma quantidade de 20 mg de tripolifosfato de sódio em um litro de água não afeta o odor, o sabor ou o pH da referida água..
Obtendo
O tripolifosfato de sódio é preparado por meio da desidratação de ortofosfatos (como o fosfato monossódico NaHdoisPO4 e fosfato dissódico NadoisHPO4) a temperaturas muito altas (300-1200 ° C):
NaHdoisPO4 + 2 NadoisHPO4 → Na5P3OU10 + 2 hdoisOU
Também pode ser obtido por calcinação controlada (significa aquecimento a uma temperatura muito elevada) de ortofosfato de sódio Na.3PO4 com carbonato de sódio NadoisCO3 e ácido fosfórico H3PO4.
Formulários
Em detergentes
O tripolifosfato de sódio tem a propriedade de formar compostos com certos íons, retendo-os. Ele também tem propriedades dispersantes para partículas de sujeira e as mantém em suspensão..
Por esse motivo, é amplamente utilizado em formulações de detergentes para reter e imobilizar íons cálcio Ca.dois+ e magnésio Mgdois+ água (a chamada água dura) e para manter a sujeira suspensa na água.
Os íons mencionados interferem na ação de limpeza. Ao prendê-los, o tripolifosfato evita que esses íons se precipitem junto com o agente de limpeza ou grudem a sujeira no tecido, evitando que a mancha se desprenda do mesmo..
Neste caso, diz-se que o tripolifosfato de sódio "amacia" a água. Por isso, é utilizado em detergentes para roupas e detergentes para máquinas de lavar louça..
Por formar hidratos estáveis, os detergentes que o contêm em sua formulação podem ser secos instantaneamente por pulverização (spray muito fino) formando pós secos..

Para uso veterinário
Tripolifosfato de sódio é usado como suplemento em soluções líquidas como fonte de fósforo para gado.

Também é usado para prevenir cálculos renais em gatos, para os quais é administrado por via oral a esses animais. No entanto, deve-se prestar atenção à dosagem, pois pode causar diarreia..

Em medicina
O tripolifosfato de sódio tem sido usado na preparação de nanopartículas para o transporte e administração adequados de drogas quimioterápicas contra o câncer. Também tem sido usado em nanopartículas para tratar infecções fúngicas nos pulmões..
Na industria alimentícia
Usado em produtos lácteos, como pudins, creme chantilly, creme de leite e queijo.

Em outros alimentos é usado como sequestrante de íons, para dar textura, como espessante e como conservante.
Outros usos
- Como estabilizador de peróxido
- Em fluidos de perfuração de poços de petróleo, funciona como um emulsificante e dispersante para controlar a viscosidade da lama.
- Na agricultura é utilizado como agente antiaglomerante para certos fertilizantes ou produtos agrícolas, o que significa que evita que se colem e o fertilizante pode ser facilmente distribuído. Também é usado em fórmulas de pesticidas aplicados em plantações.

Impacto ambiental
O uso de produtos fosfatados tem sido apontado como um dos contribuintes para a eutrofização da água no planeta.
A eutrofização é o crescimento exagerado e acelerado de algas e espécies de plantas aquáticas que leva a uma diminuição acentuada do oxigênio disponível na água, levando à destruição do ecossistema afetado (morte da maioria das espécies animais nele).

A controvérsia surgiu na década de 1980 de que o uso de tripolifosfato de sódio em detergentes estava contribuindo para a eutrofização.
Hoje se sabe que limitar o uso de detergentes com tripolifosfato de sódio contribuiria muito pouco para a eliminação da eutrofização, uma vez que os fosfatos vêm em maior quantidade de outras fontes agrícolas e industriais..
Na verdade, há países que consideram o tripolifosfato de sódio um componente ambientalmente correto dos detergentes e promovem seu uso.
Riscos
O tripolifosfato de sódio é irritante para a pele e os olhos. O contato com os olhos pode causar danos aos olhos. O contato prolongado com a pele pode causar dermatite.
Se ingerido em grandes quantidades, pode causar náuseas, vômitos e diarreia, gerando também uma grave redução do íon cálcio no sangue. Em animais, causou uma diminuição do cálcio nos ossos.
É considerado um composto seguro desde que respeitadas as normas de fabricação do produto em que é utilizado..
Referências
- Liu, Y. e Chen, J. (2014). Ciclo de fósforo. Módulo de Referência em Sistemas Terrestres e Ciências Ambientais. Enciclopédia de Ecologia (segunda edição). Vol. 4, 2014, pp. 181-191. Recuperado de sciencedirect.com
- NÓS. Biblioteca Nacional de Medicina. (2019). Tripolifosfato de sódio. Centro Nacional de Informações sobre Biotecnologia. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Mukherjee, B. et al. (2017). Administração pulmonar de nanocarreadores de drogas biodegradáveis para um tratamento mais eficaz de infecções fúngicas nos pulmões: percepções baseadas em descobertas recentes. Em Sistemas Multifuncionais para Entrega Combinada, Biossensorio e Diagnóstico. Recuperado de sciencedirect.com.
- Kirk-Othmer. (1991). Enciclopédia de Tecnologia Química. 4º Nova York, John Wiley and Sons.
- Burckett St. Laurent, J. et al. (2007). Lavagem de Têxteis. No Manual de Limpeza / Descontaminação de Superfícies. Recuperado de sciencedirect.com.
- Budavari, S. (Editor). (mil novecentos e noventa e seis). The Merck Index. NJ: Merck and Co., Inc.
- Salahuddin, N. e Galal, A. (2017). Melhorar a entrega de drogas quimioterápicas por ferramentas de nanoprecisão. In Nanostructures for Cancer Therapy. Recuperado de sciencedirect.com.



Ainda sem comentários