
Estrutura, propriedades e usos do trióxido de arsênio (As2O3)
O trióxido de arsênico é um composto inorgânico cuja fórmula química é AsdoisOU3. O arsênio em seu estado metálico é rapidamente transformado neste óxido, que é um veneno muito tóxico que pode ter manifestações agudas e crônicas..
Como arsênio e oxigênio são elementos do bloco p, com uma diferença de eletronegatividade relativamente baixa, espera-se que AsdoisOU3 é composto de natureza covalente; ou seja, que as ligações As-O predominam em seu sólido, sobre as interações eletrostáticas entre os íons As3+ Eudois-.

A intoxicação aguda com trióxido de arsênio ocorre por ingestão ou inalação, sendo as manifestações mais importantes: distúrbios gastrointestinais graves, cólicas, colapso circulatório e edema pulmonar..
No entanto, apesar de sua toxidade, tem sido usado industrialmente; por exemplo, na conservação de madeira, na produção de pigmentos, semicondutores, etc. Da mesma forma, era anteriormente usado no tratamento de inúmeras doenças.
O trióxido de arsênio é um composto anfotérico, solúvel em ácidos e álcalis diluídos, insolúvel em solventes orgânicos e relativamente solúvel em água. Ocorre como um sólido (imagem superior), com duas formas cristalinas: cúbica e monoclínica.
Índice do artigo
- 1 Estrutura do trióxido de arsênio
- 1.1 Claudetite
- 1.2 Líquido e gasoso
- 1.3 Arsenolito
- 2 propriedades
- 2.1 Nomes comerciais
- 2.2 Peso molecular
- 2.3 Aparência física
- 2.4 Odor
- 2,5 Sabor
- 2.6 Ponto de ebulição
- 2.7 Ponto de fusão
- 2.8 ponto de fulgor
- 2.9 Solubilidade em água
- 2.10 Solubilidade
- 2.11 Densidade
- 2.12 Pressão de vapor
- 2.13 Decomposição
- 2.14 Corrosividade
- 2.15 Calor de vaporização
- 2.16 Constante de dissociação (Ka)
- 2.17 Índice de refração
- 3 Reatividade
- 4 Nomenclatura
- 5 usos
- 5.1 Industrial
- 5.2 Médicos
- 6 referências
Estrutura do trióxido de arsênio
Claudetita
À temperatura ambiente, comodoisOU3 cristaliza em dois polimorfos monoclínicos, ambos encontrados no mineral claudetita. Eles têm unidades de pirâmide trigonal AsO3, que são unidos por seus átomos de oxigênio para compensar a deficiência eletrônica da unidade por conta própria.
Em um polimorfo, as unidades AsO3 estão ligados formando filas (claudetite I), e nas outras estão ligados como se estivessem a tecer uma rede (claudetite II):
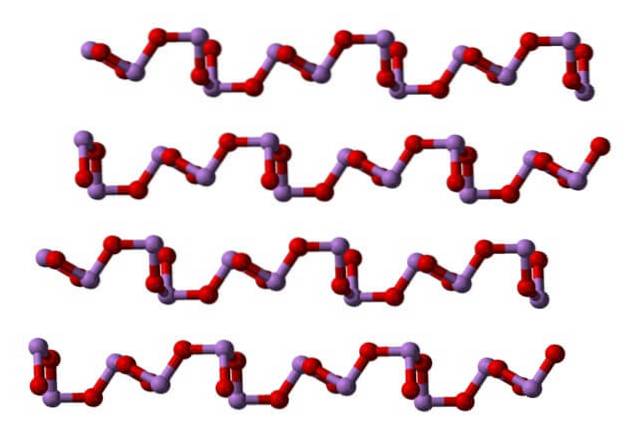
Líquido e gasoso
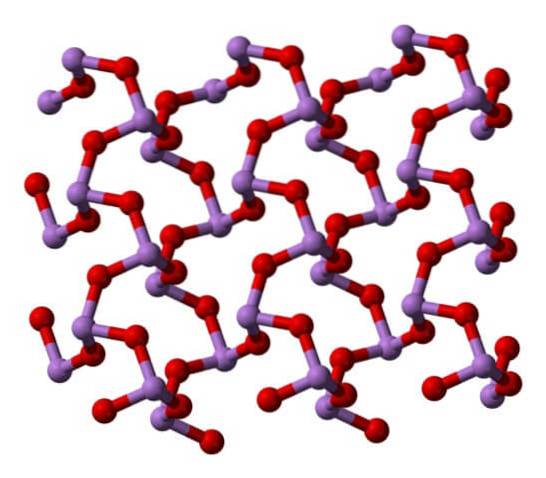
Quando todas as estruturas que definem os cristais monoclínicos são aquecidas, as vibrações são tais que várias ligações As-O são rompidas, e uma molécula menor acaba prevalecendo: As4OU6. Sua estrutura é mostrada na imagem abaixo.

Pode-se dizer que consiste em um dímero de AsdoisOU3. Sua estabilidade é tal que suporta 800 ° C na fase gasosa; mas, acima dessa temperatura, ele se fragmenta em moléculas de AsdoisOU3.
Arsenolite
O mesmo ás4OU6 podem interagir uns com os outros para se cristalizar em um sólido cúbico, cuja estrutura é encontrada no arsenolito mineral.
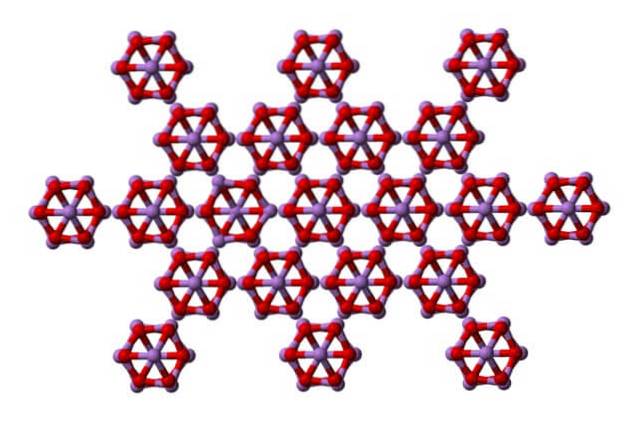
Observe que a imagem está mostrando a estrutura de um plano superior. Comparando com a claudetita, sua diferença estrutural com o arsenolito é evidente. Aqui, eles são moléculas discretas de As4OU6 que as unidades são mantidas pelas forças de Van der Waals.
Propriedades
Nomes comerciais
-Arsenolite
-Arsodent
-Trisenox
-Claudetita
Peso molecular
197,84 g / mol.
Aspecto físico
-Cristais cúbicos brancos (arsenolito).
-Cristais monoclínicos incolores (Claudetite).
-Grânulos brancos ou transparentes sólidos, vítreos, amorfos ou pó cristalino.
Odor
Banheiro.
Gosto
Insípido.
Ponto de ebulição
460 ºC.
Ponto de fusão
-313 ºC (Claudetite).
-274 ºC (arsenolito).
ponto de ignição
485 º C (sublimados).
Solubilidade em água
17 g / L a 18 ºC (20 g / L a 25 ºC).
Solubilidade
Solúvel em ácidos (especialmente ácido clorídrico) e álcalis. Praticamente insolúvel em clorofórmio e éter.
Densidade
-3,85 g / cm3 (cristais cúbicos);
-4,15 g / cm3 (cristais rômbicos).
Pressão de vapor
2,47 10-4 mmHg a 25 ºC.
Decomposição
Não é combustível, mas ao ser aquecido pode criar fumaça tóxica que pode incluir arsina..
Corrosividade
Na presença de umidade, pode ser corrosivo para os metais.
Calor da vaporização
77 kJ / mol.
Constante de dissociação (Ka)
1.110-4 a 25 ºC.
Índice de refração
-1.755 (arsenolito)
-1,92-2,01 (Claudetite).
Reatividade
-O trióxido de arsênio é um composto anfotérico, mas funciona preferencialmente como ácido.
-Pode reagir com ácido clorídrico ou ácido fluorídrico, formando tricloreto de arsênio ou trifluoreto de arsênio.
-Da mesma forma, ele reage com oxidantes fortes, como o ácido nítrico, causando ácido arsênico e óxido nitroso..
-O trióxido de arsênio pode reagir com o ácido nítrico, produzindo arsina ou o elemento arsênico, dependendo das condições de reação..
ÁsdoisOU3 + 6 Zn + 12 HNO3 => 2 AsH3 + 6 Zn (NÃO3)dois + 3 HdoisOU.
Essa reação serviu de base para a criação do Teste de Pântano, usado para detectar envenenamento por arsênico..
Nomenclatura
NodoisOU3 Pode ser nomeado de acordo com as seguintes nomenclaturas, sabendo que o arsênio trabalha com valência +3:
-Óxido de arsenoso (nomenclatura tradicional).
-Óxido de arsênio (III) (nomenclatura de estoque).
-Trióxido de diarsênio (nomenclatura sistemática).
Formulários
Industrial
-É utilizado na fabricação de vidros, especificamente como agente de branqueamento. Também é utilizado na fabricação de cerâmicas, produtos eletrônicos e fogos de artifício.
-É adicionado como um componente secundário às ligas à base de cobre, para aumentar a resistência à corrosão dos metais da liga.
-O ásdoisOU3 é o material de partida para a preparação de arsênio elementar, para melhorar as conexões elétricas e para a produção de semicondutores de arseneto
-O ásdoisOU3, assim como o arseniato de cobre, são usados como conservantes da madeira. Foi usado em combinação com acetato de cobre para fazer o pigmento verde Paris, usado para fazer tintas e rodenticidas..
Doutores
-O trióxido de arsênio é um composto usado há séculos no tratamento de muitas doenças. Foi utilizado como tônico no tratamento de distúrbios nutricionais, neuralgia, reumatismo, artrite, asma, coreia, malária, sífilis e tuberculose.
-Da mesma forma, tem sido utilizado no tratamento local de dermatoses, sendo utilizado para destruir alguns epiteliomas superficiais..
-A solução de Fowler foi usada para tratar doenças de pele e leucemia. O uso deste medicamento é interrompido..
-Na década de 1970, o pesquisador chinês Zhang Tingdong conduziu pesquisas sobre o uso de trióxido de arsênio no tratamento da leucemia promielocítica aguda (APL). O que levou à produção do medicamento Trisenox, que foi aprovado pelo FDA dos EUA.
-Trisenox tem sido usado em pacientes com APL que não respondem ao tratamento de "primeira linha", que consiste em ácido trans retinóico (ATRA). Foi demonstrado que o trióxido de arsênio induz as células cancerosas a sofrer apoptose.
-Trisenox é usado como um citostático no tratamento do subtipo promielocítico refratário (M3) por APL.
Referências
- Shen et al. (2001). Estudos sobre a eficácia clínica e farmacocinética do trióxido de arsênio em baixas doses no tratamento da leucemia promielocítica aguda recidivante: uma comparação com a dosagem convencional. Leucemia 15, 735-741.
- Science Direct. (2014). Trióxido de arsênio. The Sevier. Recuperado de: sciencedirect.com
- Wikipedia. (2019). Trióxido de arsênio. Recuperado de: en.wikipedia.org
- PubChem. (2019). Óxido de arsênio (III). Recuperado de: pubchem.ncbi.nlm.nih.gov
- Deborah M. Rusta e Steven L. Soignetb. (2001). Perfil de risco / benefício do trióxido de arsênio. The Oncologist vol. 6 Suplemento 2 29-32.
- O novo jornal inglês de medicina. (11 de julho de 2013). Ácido retinóico e trióxido de arsênio para leucemia promielocítica aguda. n engl j med 369; 2.



Ainda sem comentários