
Voltametria em que consiste, tipos e aplicações
O voltametria É uma técnica eletroanalítica que determina informações de uma espécie química ou analito a partir das correntes elétricas geradas pela variação de um potencial aplicado. Ou seja, o potencial aplicado E (V), e o tempo (t), são as variáveis independentes; enquanto o atual (A), a variável dependente.
As espécies químicas normalmente devem ser eletroativas. Oque quer dizer? Isso significa que ele deve perder (oxidar) ou ganhar (reduzir) elétrons. Para que a reação comece, o eletrodo de trabalho deve fornecer o potencial necessário determinado teoricamente pela equação de Nernst.
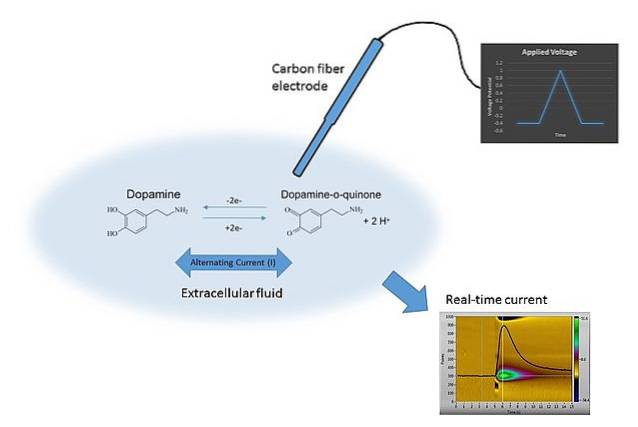
Um exemplo de voltametria pode ser visto na imagem acima. O eletrodo da imagem é feito de fibras de carbono, que está imerso no meio de dissolução. A dopamina não oxida, formando dois grupos carbonila C = O (lado direito da equação química), a menos que o potencial adequado seja aplicado.
Isso é obtido pela varredura de E com valores diferentes, limitados por muitos fatores, como a solução, os íons presentes, o mesmo eletrodo e dopamina..
Variando E ao longo do tempo, dois gráficos são obtidos: o primeiro E v t (o triângulo azul), e o segundo, a resposta C vs t (amarelo). Suas formas são características para a determinação da dopamina nas condições do experimento..
Índice do artigo
- 1 O que é voltametria??
- 1.1 Onda voltamétrica
- 1.2 Instrumentação
- 2 tipos
- 2.1 Voltametria de pulso
- 2.2 Voltametria de redissolução
- 3 aplicativos
- 4 referências
O que é voltametria?
A voltametria foi desenvolvida graças à invenção da técnica de polarografia pelo ganhador do Prêmio Nobel de Química em 1922, Jaroslav Heyrovsky. Nele, o eletrodo da gota de mercúrio (EGM) é constantemente renovado e polarizado.
As deficiências analíticas desse método na época foram resolvidas com o uso e projeto de outros microeletrodos. Estes variam enormemente em material, desde carbono, metais nobres, diamante e polímeros, até em seu design, discos, cilindros, folhas; e também, na forma como interagem com a solução: estacionárias ou rotativas.
Todos esses detalhes têm o objetivo de favorecer a polarização do eletrodo, o que provoca um decaimento da corrente registrada conhecido como corrente limite (i1) Isso é proporcional à concentração do analito e metade da potência E (E1/2) para atingir a metade da referida corrente (i1/2) é característico da espécie.
Então, determinar os valores de E1/2 na curva onde a corrente obtida com a variação de E, chamada voltamperograma, a presença de um analito pode ser identificada. Ou seja, cada analito, dadas as condições do experimento, terá seu próprio valor de E1/2.
Onda voltamétrica
Na voltametria, você trabalha com muitos gráficos. A primeira delas é a curva E vs t, que permite acompanhar as diferenças de potencial aplicadas em função do tempo..
Mas, ao mesmo tempo, o circuito elétrico registra os valores de C produzidos pelo analito ao perder ou ganhar elétrons nas proximidades do eletrodo..
Como o eletrodo é polarizado, menos analito pode se difundir de dentro da solução para dentro dele. Por exemplo, se o eletrodo é carregado positivamente, a espécie X- será atraído por ele e irá em direção a ele por mera atração eletrostática.
Mas X- Você não está sozinho: existem outros íons presentes em seu ambiente. Alguns cátions M+ eles podem atrapalhar o eletrodo, envolvendo-o em "grupos" de cargas positivas; e da mesma forma, N ânions- pode ficar preso ao redor do eletrodo e evitar X- Eu peguei ele.
A soma desses fenômenos físicos faz com que a corrente seja perdida, e isso é observado na curva C vs E e sua forma semelhante a de um S, chamada de forma sigmóide. Esta curva é conhecida como onda voltamétrica..
Instrumentação
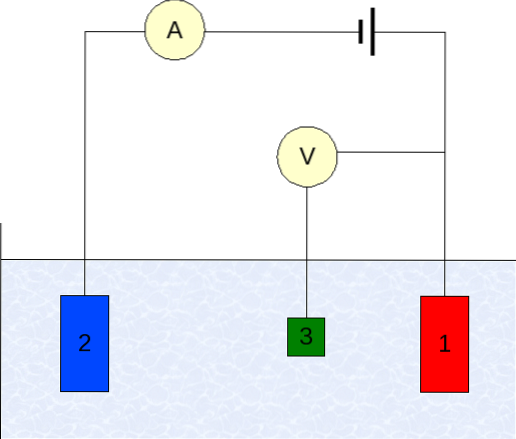
A instrumentação da voltametria varia de acordo com o analito, solvente, tipo de eletrodo e aplicação. Porém, a grande maioria deles é baseada em um sistema composto por três eletrodos: um de trabalho (1), auxiliar (2) e o de referência (3)..
O eletrodo de referência principal utilizado é o eletrodo de calomelano (ECS). Este, em conjunto com o eletrodo de trabalho, permite estabelecer uma diferença de potencial ΔE, uma vez que o potencial do eletrodo de referência permanece constante durante as medições..
Por outro lado, o eletrodo auxiliar é responsável por controlar a carga que passa para o eletrodo de trabalho, de forma a mantê-la dentro de valores E aceitáveis. A variável independente, a diferença de potencial aplicada, é aquela obtida pela soma dos potenciais dos eletrodos de trabalho e de referência..
Tipos

A imagem acima mostra um gráfico E vs t, também chamado de onda potencial para voltametria de varredura linear..
Percebe-se que com o passar do tempo o potencial aumenta. Por sua vez, esta varredura gera uma curva de resposta ou voltamperograma C vs E cuja forma será sigmóide. Chegará um ponto em que não importa o quanto E aumente, não haverá aumento na corrente.
Outros tipos de voltametria podem ser inferidos a partir deste gráfico. Como? Modificando a onda potencial E vs t através de pulsos de potencial repentinos seguindo certos padrões Cada padrão está associado a um tipo de voltametria e abrange sua própria teoria e condições experimentais..
Voltametria de pulso
Neste tipo de voltametria, misturas de dois ou mais analitos cujos valores E podem ser analisados1/2 estão muito próximos uns dos outros. Assim, um analito com E1/2 de 0,04V pode ser identificado na companhia de outro com um E1/2 de 0,05V. Enquanto na voltametria de varredura linear, a diferença deve ser maior que 0,2V.
Portanto, há maior sensibilidade e limites de detecção mais baixos; ou seja, os analitos podem ser determinados em concentrações muito baixas.
As ondas de potenciais podem ter padrões semelhantes a escadas, escadas inclinadas e triângulos. Este último corresponde à voltametria cíclica (CV por sua sigla em Inglês, primeira imagem).
Em CV, um potencial E é aplicado em uma direção, positiva ou negativa, e então, a um certo valor de E no tempo t, o mesmo potencial é aplicado novamente, mas na direção oposta. Ao estudar os voltamperogramas gerados, os máximos revelam a presença de intermediários em uma reação química.
Voltametria de redissolução
Pode ser do tipo anódico ou catódico. Consiste na eletrodeposição do analito em um eletrodo de mercúrio. Se o analito for um íon metálico (como Cddois+), um amálgama se formará; e se for um ânion, (como MoO4dois-) um sal de mercúrio insolúvel.
Em seguida, pulsos de potenciais são aplicados para determinar a concentração e identidade das espécies eletrodepositadas. Assim, o amálgama é redissolvido, como os sais de mercúrio.
Formulários
-A voltametria de redissolução anódica é usada para determinar a concentração de metais dissolvidos no fluido.
-Permite estudar a cinética dos processos redox ou adsorção, principalmente quando os eletrodos são modificados para detectar um analito específico..
-Sua base teórica tem sido utilizada para a fabricação de biossensores. Com eles, a presença e a concentração de moléculas biológicas, proteínas, gorduras, açúcares, etc. podem ser determinadas..
-Por fim, detecta a participação de intermediários nos mecanismos de reação.
Referências
- González M. (22 de novembro de 2010). Voltametria. Recuperado de: quimica.laguia2000.com
- Gómez-Biedma, S., Soria, E., & Vivó, M… (2002). Análise eletroquímica. Journal of Biological Diagnosis, 51 (1), 18-27. Recuperado de scielo.isciii.es
- Química e Ciência. (18 de julho de 2011). Voltametria. Recuperado de: laquimicaylaciencia.blogspot.com
- Quiroga A. (16 de fevereiro de 2017). Voltametria cíclica. Recuperado de: chem.libretexts.org
- Samuel P. Kounaves. (s.f.). Técnicas Voltamétricas. [PDF]. Tufts University. Recuperado de: brown.edu
- Dia R. e Underwood A. Química Analítica Quantitativa (quinta edição). PEARSON Prentice Hall.


Ainda sem comentários