
Propriedades do óxido de cloro (V), estrutura, usos
O óxido de cloro (V) é um composto inorgânico altamente instável, cuja fórmula química é CldoisOU5. É um dos muitos óxidos de cloro, que se caracterizam por serem espécies moleculares, ou mesmo radicais.
O CldoisOU5 Ele só encontrou vida no papel e em cálculos teóricos; entretanto, sua existência não foi descartada e é provável que alguns possam ser caracterizados (por técnicas avançadas de espectroscopia). O que pode ser previsto a partir dos conceitos de química geral desse óxido é que ele é o anidrido do ácido clorídrico, HClO3.
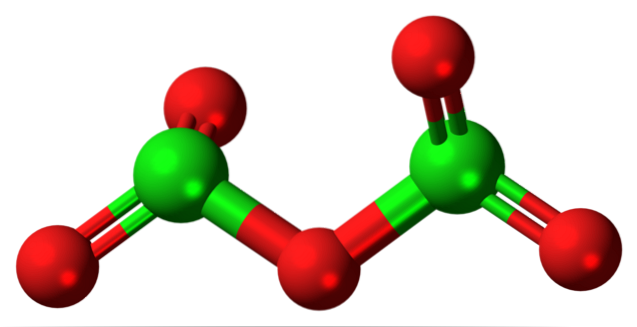
A hipotética molécula de óxido de cloro (V) é mostrada acima. Observe que, por ser uma molécula, a presença do íon Cl não é considerada de forma alguma+5; ainda menos quando deve ter tal poder de polarização para forçar o oxigênio a se ligar covalentemente.
Como todos os compostos instáveis, ele libera energia para se decompor em produtos mais estáveis; processo que em muitos casos é explosivo. Quando o CldoisOU5 decompõe liberações ClOdois Eudois. É teorizado que na água, dependendo do isômero de CldoisOU5, pode formar vários oxoácidos de cloro.
Índice do artigo
- 1 propriedades
- 2 Estrutura do óxido de cloro (V)
- 2.1 Molécula
- 2.2 Estrutura de Lewis
- 2.3 Isômeros e sua respectiva hidrólise
- 3 Nomenclatura
- 4 usos
- 5 referências
Propriedades
A massa molar de CldoisOU5 é 150,9030 g / mol. Dessa massa, e de sua molécula hipotética, pode-se conjeturar que, se pudesse ser isolada, provavelmente seria um líquido oleoso; claro, comparando-o com a aparência física do CldoisOU7.
Embora não possa ser isolado ou caracterizado, este óxido de cloro é ácido, covalente e também deve ter um pequeno momento dipolar. Sua acidez é compreensível se a equação química de sua hidrólise for analisada:
CldoisOU5 + HdoisO 2HClO3
Sendo o HClO3 ácido clórico. A reação reversa resultaria no caso em que o ácido pode ser desidratado:
2HClO3 => CldoisOU5 + HdoisOU
Por outro lado, quando o CldoisOU5 dificilmente produzido, ele se decompõe:
2CldoisOU5 => 4ClOdois + OUdois
Portanto, é uma espécie intermediária em vez de um óxido propriamente dito. Sua decomposição deve ser tão rápida (considerando que mesmo CldoisOU5), que não foi detectado pelas técnicas atuais de análise instrumental.
Estrutura do óxido de cloro (V)
Molécula
Na imagem superior, a estrutura da hipotética molécula de Cl foi mostrada.doisOU5 com um modelo de esferas e barras. As esferas vermelhas representam átomos de oxigênio e as esferas verdes representam átomos de cloro. Cada cloro tem um ambiente de pirâmide trigonal, então sua hibridização deve ser sp3.
Assim, a molécula de CldoisOU5 pode ser visto como duas pirâmides trigonais ligadas por um oxigênio. Mas se você olhar com atenção, uma pirâmide orienta seus átomos de oxigênio para baixo, a outra para fora do plano (em direção ao leitor)..
Portanto, presume-se que há rotações no link OdoisCl-O-ClOdois, tornando a molécula relativamente dinâmica. Observe que a fórmula OdoisCHLOClOdois é uma forma de representar a estrutura de CldoisOU5.
Estrutura de Lewis
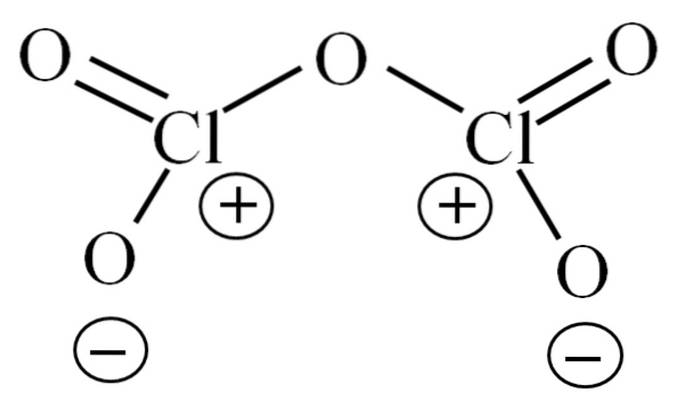
Até agora, a molécula por si só não permitiu decifrar a que se deve sua instabilidade. Para lançar luz sobre esta questão, nos voltamos para sua estrutura de Lewis, descrita acima. Observe que a estrutura pode ser erroneamente considerada plana, mas na subseção anterior foi esclarecido que este não é o caso..
Por que ambos os átomos de cloro têm cargas formais positivas? Porque o cloro ainda tem um par de elétrons livre, o que pode ser verificado aplicando-se a Teoria Valencia Bond (o que não será feito aqui para fins de simplificação). Assim, sua carga formal é:
CF = 7 - (4 + 2) = 1
E o que isso tem a ver com sua instabilidade? Bem, o cloro é consideravelmente eletronegativo e, portanto, um pobre portador de cargas formais positivas. Isso retorna ao CldoisOU5 uma espécie altamente ácida, pois precisa ganhar elétrons para suprir a demanda eletrônica pelos dois clores..
O contrário acontece com o BrdoisOU5 e eudoisOU5, óxidos que existem em condições normais. Isso ocorre porque tanto o bromo quanto o iodo são menos eletronegativos que o cloro; e, portanto, eles apoiam melhor a acusação formal positiva.
Isômeros e sua respectiva hidrólise
Até agora, toda a explicação caiu em um dos dois isômeros de CldoisOU5: o OdoisCHLOClOdois. Qual é o outro? O O3CHLOClO. Neste isômero, os cloro não possuem cargas positivas formais e, portanto, devem ser uma molécula mais estável. No entanto, tanto o OdoisCHLOClOdois como o O3ClOClO deve sofrer reações de hidrólise:
OUdoisCl-O-ClOdois + HdoisO => 2OdoisCl-OH (que nada mais são do que HClO3)
OU3Cl-O-ClO + HdoisO => O3Cl-OH (HClO4) + HO-ClO (HClOdois)
Observe que até três oxoácidos de cloro podem ser formados: HClO3, HClO4 e HClOdois
Nomenclatura
A denominação 'óxido de cloro (V)' corresponde à designada de acordo com a nomenclatura do estoque. O CldoisOU5 Também pode ter outros dois nomes: dicloro pentóxido e anidrido clórico, atribuídos pelas nomenclaturas sistemática e tradicional, respectivamente..
Formulários
Mais do que motivar estudos computacionais, o CldoisOU5 Não será usado até que seja descoberto, isolado, caracterizado, armazenado e mostrado que não explode ao menor contato..
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Sandra Luján Quiroga e Luis José Perissinotti. (2011). Oxoácidos de cloro e estrutura de óxidos de dicloro. Chem. Educator, Vol. 16.
- Formulação Química. (2019). Óxido de cloro (V). Recuperado de: formulacionquimica.com
- Linus Pauling. (1988). Química Geral. Dover Publications, INC., Nova York.
- Richard C. Ropp. (2013). Enciclopédia dos compostos alcalinos da terra. Elsevier.


Ainda sem comentários