
Estrutura do óxido de estanho (II), propriedades, nomenclatura, usos

O óxido de estanho (II) é um sólido inorgânico cristalino que é formado pela oxidação do estanho (Sn) pelo oxigênio, onde o estanho adquire uma valência 2+. Sua fórmula química é SnO. Duas formas diferentes deste composto são conhecidas: preto e vermelho. A forma comum e mais estável à temperatura ambiente é a modificação preta ou preto-azulado..
Esta forma é preparada por hidrólise de cloreto de estanho (II) (SnCldois) em solução aquosa, à qual é adicionado hidróxido de amônio (NH4OH) para obter um precipitado de óxido hidratado de Sn (II) cuja fórmula é SnO.xHdoisOu, onde x<1 (x menor que 1).
O óxido hidratado é um sólido amorfo branco, que é então aquecido em suspensão a 60-70 ºC por várias horas na presença de NH4OH, até obter o SnO cristalino preto puro.
A forma vermelha do SnO é metaestável. Pode ser preparado adicionando ácido fosfórico (H3PO4) - com 22% de ácido fosforoso, H3PO3 - e então NH4OH para uma solução SnCldois. O sólido branco obtido é aquecido na mesma solução a 90-100 ° C durante cerca de 10 minutos. Desta forma, o SnO cristalino vermelho puro é obtido.
O óxido de estanho (II) é um material de partida para a produção de outros compostos de estanho (II). Por este motivo, é um dos compostos de estanho com apreciável importância comercial..
O óxido de estanho (II) tem baixa toxicidade, como ocorre com a maioria dos compostos inorgânicos de estanho. Isso se deve à sua má absorção e rápida excreção dos tecidos dos seres vivos..
Ele tem uma das tolerâncias mais altas de compostos de estanho em testes em ratos. No entanto, pode ser prejudicial se inalado em grandes quantidades..
Índice do artigo
- 1 Estrutura
- 1.1 Óxido de estanho (II) preto-azulado
- 1,2 Óxido de estanho (II) vermelho
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Densidade
- 3.5 Solubilidade
- 3.6 Outras propriedades
- 4 usos
- 4.1 Na produção de outros compostos de estanho (II)
- 4.2 Em joias
- 4.3 Outros usos
- 4.4 Inovações recentes
- 5 referências
Estrutura
Óxido de estanho (II) preto-azulado
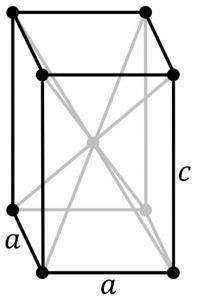
Essa modificação se cristaliza com uma estrutura tetragonal. Possui um arranjo de camadas em que cada átomo de Sn está no topo de uma pirâmide quadrada, cuja base é formada pelos 4 átomos de oxigênio mais próximos.
Outros pesquisadores afirmam que cada átomo de Sn é cercado por 5 átomos de oxigênio que estão localizados aproximadamente nos vértices de um octaedro, onde o sexto vértice é presumivelmente ocupado por um par de elétrons livres ou desemparelhados. Isso é conhecido como arranjo Φ-octaédrico.
Óxido de estanho (II) vermelho
Esta forma de óxido de estanho (II) cristaliza com uma estrutura ortorrômbica.
Nomenclatura
- Óxido de estanho (II)
- Óxido estanoso
- Monóxido de estanho
- Óxido estanoso
Propriedades
Estado físico
Sólido cristalino.
Peso molecular
134,71 g / mol.
Ponto de fusão
1080 ºC. Se decompõe.
Densidade
6,45 g / cm3
Solubilidade
Insolúvel em água quente ou fria. Insolúvel em metanol, mas se dissolve rapidamente em ácidos e álcalis concentrados.
Outras propriedades
Se aquecido a mais de 300 ºC na presença de ar, o óxido de estanho (II) oxida rapidamente em óxido de estanho (IV), apresentando incandescência.
Foi relatado que em condições não oxidantes, o aquecimento do óxido de estanho (II) tem resultados diferentes dependendo do grau de pureza do óxido de partida. Geralmente desproporcional em Sn metálico e óxido de estanho (IV), SnOdois, com várias espécies intermediárias que eventualmente se tornam SnOdois.
O óxido de estanho (II) é anfotérico, pois se dissolve em ácidos para dar íons Sndois+ ou complexos de ânions, e também se dissolve em álcalis para formar soluções de íons hidroxi-tinnato, Sn (OH)3-, que tem uma estrutura piramidal.
Além disso, o SnO é um agente redutor e reage rapidamente com ácidos orgânicos e minerais..
Possui baixa toxicidade quando comparado a outros sais de estanho. Seu LD50 (dose letal de 50% ou dose letal mediana) em ratos é superior a 10.000 mg / kg. Isso significa que mais de 10 gramas por quilograma são necessários para matar 50% das amostras de ratos em um determinado período de teste. Em comparação, o fluoreto estanoso (II) tem um DL50 de 188 mg / Kg em ratos..
No entanto, se inalado por um longo tempo, é depositado nos pulmões porque não é absorvido e pode causar estanose (infiltração de pó de SnO nos interstícios pulmonares).
Formulários
Na produção de outros compostos de estanho (II)
Sua rápida reação com ácidos é a base de seu uso mais importante, que é como intermediário na fabricação de outros compostos de estanho..
É utilizado na produção de brometo de estanho (II) (SnBrdois), cianeto de estanho (II) (Sn (CN)dois) e hidrato de fluoroborato de estanho (II) (Sn (BF4)dois), entre outros compostos de estanho (II).
O fluoroborato de estanho (II) é preparado pela dissolução de SnO em ácido fluorobórico e é utilizado para revestimentos de estanho e estanho-chumbo, especialmente na deposição de ligas de estanho-chumbo para soldagem na indústria eletrônica. Isso se deve, entre outras coisas, à sua alta capacidade de cobertura.
O óxido de estanho (II) também é usado na preparação de sulfato de estanho (II) (SnSO4), por meio da reação de SnO e ácido sulfúrico, HdoisSW4.
O SnSO4 obtida é utilizada no processo de estanhagem para a produção de placas de circuito impresso, para o acabamento de contatos elétricos e para a estanhagem de utensílios de cozinha.

A forma hidratada de SnO, o óxido de estanho (II) hidratado SnO.xHdoisOu então, é tratado com ácido fluorídrico para obter fluoreto estanoso (II), SnFdois, que é adicionado às pastas de dente como um agente para combater as cáries.
Em joias
O óxido de estanho (II) é usado na preparação de cristais de ouro-estanho e cobre-estanho-rubi. Aparentemente, sua função nesta aplicação é atuar como um agente redutor.

Outros usos
Tem sido usado em dispositivos fotovoltaicos para a produção de eletricidade a partir da luz, como células solares..

Inovações recentes
Nanopartículas de SnO arranjadas têm sido usadas em eletrodos de nanotubos de carbono para baterias de lítio-enxofre.

Eletrodos preparados com SnO exibem alta condutividade e pouca mudança de volume em ciclos repetitivos de carga e descarga.
Além disso, o SnO facilita a transferência rápida de íons / elétrons durante as reações de oxidação-redução que ocorrem em tais baterias..
Referências
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Bailar, J.C.; Emeléus, H.J.; Sir Ronald Nyholm e Trotman-Dickenson, A.F. (1973). Comprehensive Inorganic Chemistry. Volume 2. Pergamon Press.
- Enciclopédia de Química Industrial de Ullmann. (1990). Quinta edição. Volume A27. VCH Verlagsgesellschaft mbH.
- Kirk-Othmer (1994). Enciclopédia de Tecnologia Química. Volume 24. Quarta edição. John Wiley & Sons.
- Ostrakhovitch, Elena A. e Cherian, M. George. (2007). Lata. Em Handbook of the Toxicology of Metals. Terceira edição. Recuperado de sciencedirect.com.
- Kwestroo, W. e Vromans, P.H.G.M. (1967). Preparação de três modificações de óxido de estanho (II) puro. J. Inorg. Nucl. Chem., 1967, Vol. 29, pp. 2187-2190.
- Fouad, S.S et al. (1992). Propriedades ópticas de filmes finos de óxido estanoso. Czechoslovak Journal of Physics. Fevereiro de 1992, Volume 42, Edição 2. Recuperado de springer.com.
- A-Young Kim et al. (2017). Solicitou nanopartículas de SnO em MWCNT como um material hospedeiro funcional para cátodo de bateria de lítio-enxofre de alta taxa. Nano Research 2017, 10 (6). Recuperado de springer.com.
- Biblioteca Nacional de Medicina. (2019). Óxido estanoso. Recuperado de: pubchem.ncbi.nlm.nih.gov


Ainda sem comentários