
Óxido de fósforo (v) estrutura, propriedades, obtenção, usos, riscos

O óxido de fósforo (v) É um sólido inorgânico formado por fósforo (P) e oxigênio (O). Sua fórmula empírica é PdoisOU5, enquanto sua fórmula molecular correta é P4OU10. É um sólido branco muito higroscópico, ou seja, pode absorver a água do ar com muita facilidade, reagindo imediatamente com ela. A reação pode ser perigosa, pois causa um rápido aumento da temperatura.
Sua alta tendência a absorver água fez com que fosse utilizado como agente secante em laboratórios químicos, bem como desidratador de alguns compostos, ou seja, para eliminar a água de suas moléculas..

O óxido de fósforo (v) também é usado para acelerar as reações de ligação de várias moléculas de hidrocarbonetos, uma reação chamada condensação. Além disso, permite converter certos ácidos orgânicos em ésteres.
Tem sido usado, por exemplo, para refinar gasolina, para preparar ácido fosfórico H3PO4, para obter compostos que servem para retardar o fogo, para fazer vidro para aplicações a vácuo, entre muitos outros usos.
O óxido de fósforo (v) deve ser mantido em recipientes bem fechados para evitar que entre em contato com a umidade do ar. É corrosivo e pode causar lesões nos olhos, pele e membranas mucosas..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Temperatura de sublimação
- 3,5 Densidade
- 3.6 Solubilidade
- 3.7 Propriedades químicas
- 3.8 Outras propriedades
- 4 Obtendo
- 4.1 Presença na natureza
- 5 usos
- 5.1 Como agente desidratante e secante
- 5.2 Em reações de química orgânica
- 5.3 No refino de combustível
- 5.4 Em várias aplicações
- 6 riscos
- 7 referências
Estrutura
O óxido de fósforo (v) é composto de fósforo (P) e oxigênio (O), onde o fósforo tem valência +5 e o oxigênio -2. A molécula de óxido de fósforo (v) tem quatro átomos de fósforo e dez átomos de oxigênio e é por isso que sua fórmula molecular correta é P4OU10.
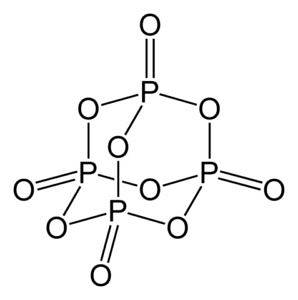
Ele existe em três formas cristalinas, como pó amorfo e na forma vítrea (como vidro). Na forma cristalina hexagonal, cada um dos átomos de fósforo é encontrado nos vértices de um tetraedro..
Nomenclatura
- Óxido de fósforo (v)
- Pentóxido de fósforo
- Pentóxido difosforoso
- Pentóxido fosfórico
- Anidrido fosfórico
- Decaóxido de tetrafósforo
Propriedades
Estado físico
Sólido branco cristalino. A forma mais comum é a de cristais hexagonais.
Peso molecular
283,89 g / mol
Ponto de fusão
562 ºC
Temperatura de sublimação
360 ºC à pressão de 1 atmosfera. Isso significa que a essa temperatura ele passa do estado sólido ao gasoso sem passar pelo estado líquido.
Densidade
2,30 g / cm3
Solubilidade
Muito solúvel em água. Solúvel em ácido sulfúrico. Insolúvel em acetona e amônia.
Propriedades quimicas
O óxido de fósforo (v) absorve e reage com a água no ar de forma extremamente rápida, formando ácido fosfórico H3PO4. Esta reação é exotérmica, o que significa que o calor é produzido durante a reação..
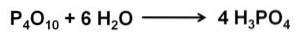
A reação de P4OU10 com água leva à formação de uma mistura de ácidos fosfóricos cuja composição depende da quantidade de água e das condições.
A reação com álcoois leva à formação de ésteres de ácido fosfórico ou de ácidos poliméricos dependendo das condições experimentais..
P4OU10 + 6 ROH → 2 (RO)doisPO.OH + 2 RO.PO (OH)dois
Com óxidos básicos, forma fosfatos sólidos.
É corrosivo. Pode reagir perigosamente com ácido fórmico e bases inorgânicas, como hidróxido de sódio (NaOH), óxido de cálcio (CaO) ou carbonato de sódio NadoisCO3.
Se você derramar uma solução de ácido perclórico HClO4 e clorofórmio CHCl3 em óxido de fósforo (v) P4OU10 uma explosão violenta ocorre.
Outras propriedades
Não é inflamável. Não promove a combustão. No entanto, sua reação com a água é tão violenta e exotérmica que pode haver risco de incêndio..
Obtendo
Pode ser preparado por oxidação direta do fósforo em uma corrente de ar seco. O fósforo, quando entra em contato com o excesso de oxigênio, oxida-se formando óxido de fósforo (v).
P4 + 5 Odois → P4OU10
Presença na natureza
O óxido de fósforo (v) é encontrado em minerais como ilmenita, rutilo e zircão.
A ilmenita é um mineral que contém ferro e titânio e às vezes possui óxido de fósforo (v) em concentrações que variam entre 0,04 e 0,33% em peso. Rutilo é um mineral de óxido de titânio e pode conter cerca de 0,02% em peso de PdoisOU5.
Areias de zircão (um mineral do elemento zircônio) possuem óxido de fósforo (v) em 0,05-0,39% em peso.
Formulários
Como um agente desidratante e secante
Devido à sua grande ganância por água, é um dos desidratantes mais conhecidos e muito eficaz em temperaturas abaixo de 100 ° C..
Ele pode extrair água de substâncias que são consideradas agentes desidratantes. Por exemplo, você pode remover a água do ácido sulfúrico HdoisSW4 transformando-o em SO3 e ácido nítrico HNO3 transformando-o em NdoisOU5.

Basicamente, pode secar todos os líquidos e gases com os quais não reage, por isso permite remover vestígios de humidade dos sistemas de vácuo.
Em reações de química orgânica
O óxido de fósforo (v) serve para fechar anéis de compostos orgânicos e outras reações de condensação.
Permite esterificar ácidos orgânicos com a possibilidade de distinguir entre ácidos carboxílicos alifáticos primários (cadeia de carbono sem anéis com o grupo -COOH em uma extremidade) e ácidos aromáticos (grupo -COOH ligado ao anel benzênico), desde que estes últimos não reajam.
Também serve para remover uma molécula de HdoisO das amidas R (C = O) NHdois e os converte em nitrilos R-CN. Além disso, catalisa ou acelera as reações de oxigenação, desidrogenação e polimerização do betume.

No refino de combustível
Desde a década de 30 do século 20, alguns estudos indicavam que o óxido de fósforo (v) exercia uma ação refinadora sobre a gasolina, aumentando seu número de octanas..
A ação refinadora de P4OU10 é principalmente devido a reações de condensação (união de moléculas diferentes) e não polimerização (união de moléculas iguais).
O p4OU10 acelera a alquilação direta de hidrocarbonetos aromáticos com olefinas, a conversão de olefinas em naftenos e sua polimerização parcial. A reação de alquilação aumenta o número de octanas da gasolina.
Desta forma, uma gasolina refinada de alta qualidade é obtida.

Em várias aplicações
O óxido de fósforo (v) é usado para:
- Prepare ácido fosfórico H3PO4
- Obtenha ésteres de acrilato e surfactantes
- Prepare ésteres de fosfato que são usados como retardadores de chama, solventes e diluentes
- Conversão de tricloreto de fósforo em oxicloreto de fósforo
- Reagente de laboratório
- Fabricação de vidros especiais para tubos de vácuo
- Aumenta o ponto de fusão do asfalto
- Servir como molécula padrão na determinação de fósforo ou fosfatos em rocha fosfática, fertilizantes e cimento Portland, na forma de PdoisOU5
- Melhoram as ligações entre certos polímeros e a camada de marfim que os dentes têm

Riscos
O óxido de fósforo (v) deve ser mantido em recipientes fechados e em locais frescos, secos e bem ventilados.
Isso serve para evitar que entre em contato com a água, pois pode reagir violentamente com ela, gerando muito calor, a ponto de queimar materiais próximos que são combustíveis..
O pó de óxido de fósforo (v) é irritante para os olhos e o trato respiratório e corrosivo para a pele. Pode causar queimaduras nos olhos. A ingestão causa queimaduras internas fatais.
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Anidrido fosfórico. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Nayler, P. (2001). Bitumens: modificado. Modificação Química. Na Enciclopédia de Materiais: Ciência e Tecnologia. Recuperado de sciencedirect.com.
- Malishev, B.W. (1936). Pentoóxido de Fósforo como Agente Refinador de Gasolina. Industrial & Engineering Chemistry 1936, 28, 2, 190-193. Recuperado de pubs.acs.org.
- Epps, Jr. E.A. (1950). Determinação fotométrica do pentóxido de fósforo disponível em fertilizantes. Analytical Chemistry 1950, 22, 8, 1062-1063. Recuperado de pubs.acs.org.
- Banerjee, A. et al. (1983). Uso do pentóxido de fósforo: Esterificação de ácidos orgânicos. J. Org. Chem. 1983, 48, 3108-3109. Recuperado de pubs.acs.org.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Kirk-Othmer (1994). Enciclopédia de Tecnologia Química. Quarta edição. John Wiley & Sons.
- Ogliari, F.A. et al. (2008). Síntese de monômeros de fosfato e ligação à dentina: Métodos de esterificação e uso de pentóxido de fósforo. Journal of Dentistry, Volume 36, Issue 3, March 2008, pages 171-177. Recuperado de sciencedirect.com.



Ainda sem comentários