
Estrutura, propriedades, usos, produção do óxido de silício (SiO2)
O óxido de silício É um sólido inorgânico formado pela união de um átomo de silício e dois de oxigênio. Sua fórmula química é SiOdois. Este composto natural também é chamado de sílica ou dióxido de silício..
O SiOdois É o mineral mais abundante na crosta terrestre, pois a areia é composta por sílica. Dependendo de sua estrutura, a sílica pode ser cristalina ou amorfa. É insolúvel em água, mas se dissolve em álcalis e em ácido fluorídrico HF.

O SiOdois também está presente na estrutura de certas plantas, bactérias e fungos. Também em esqueletos de organismos marinhos. Além da areia, existem também outros tipos de pedras que são a sílica.
A sílica é amplamente utilizada, cumprindo uma variedade de funções. O uso mais difundido é como material de filtro para líquidos como óleos e derivados de petróleo, bebidas como cerveja e vinho, bem como sucos de frutas..
Mas tem muitas outras aplicações. Uma das mais úteis e importantes é a fabricação de vidros bioativos, que permitem fazer "andaimes" onde crescem as células ósseas para produzir pedaços de ossos perdidos por acidente ou doença..
Índice do artigo
- 1 Estrutura
- 2 Nomenclatura
- 3 propriedades
- 3.1 Estado físico
- 3.2 Peso molecular
- 3.3 Ponto de fusão
- 3.4 Ponto de ebulição
- 3,5 Densidade
- 3.6 Solubilidade
- 3.7 Propriedades químicas
- 4 Presença na natureza
- 4.1 Outros tipos de sílica natural
- 5 Obtendo
- 6 usos
- 6.1 Em várias aplicações
- 6.2 Na indústria de alimentos
- 6.3 Na indústria farmacêutica
- 6.4 Na indústria de cosméticos e cuidados pessoais
- 6.5 Em aplicações terapêuticas
- 7 riscos
- 8 referências
Estrutura
Dióxido de silício SiOdois é uma molécula de três átomos, na qual o átomo de silício está ligado a dois átomos de oxigênio com ligações covalentes.
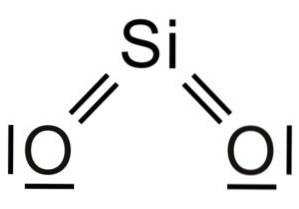
A unidade estrutural da sílica sólida como tal é um tetraedro onde um átomo de silício é rodeado por 4 átomos de oxigênio.
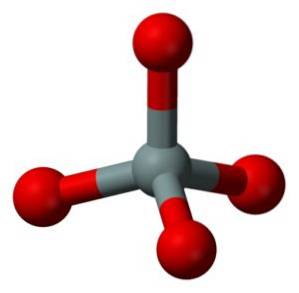
Os tetraedros são unidos compartilhando os átomos de oxigênio de seus vértices contíguos.
É por isso que um átomo de silício compartilha cada um dos 4 átomos de oxigênio pela metade e isso explica a relação no composto de 1 átomo de silício para 2 átomos de oxigênio (SiOdois).

Compostos de SiOdois são divididos em dois grupos: sílica cristalina e sílica amorfa.
Compostos de sílica cristalina têm estruturas padrão de repetição de silício e oxigênio.
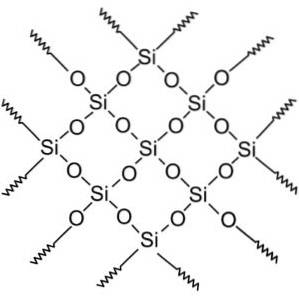
Todo o cristal de sílica pode ser considerado uma molécula gigante onde a estrutura do cristal é muito forte. Os tetraedros podem ser ligados de várias maneiras, dando origem a várias formas cristalinas.
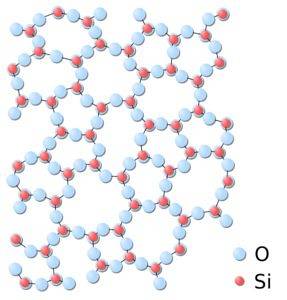
Na sílica amorfa, as estruturas são anexadas aleatoriamente, sem seguir um padrão regular definido entre as moléculas e estas estão em uma relação espacial diferente entre si..
Nomenclatura
-Óxido de silício
-Dióxido de silício
-Sílica
-Quartzo
-Tridimita
-Cristobalita
-Dioxosilano
Propriedades
Estado físico
Incolor a cinza sólido.

Peso molecular
60,084 g / mol
Ponto de fusão
1713 ºC
Ponto de ebulição
2230 ºC
Densidade
2,17-2,32 g / cm3
Solubilidade
Insolúvel em água. A sílica amorfa é solúvel em álcalis, especialmente se for finamente dividida. Solúvel em ácido fluorídrico HF.
A sílica amorfa é menos hidrofílica, ou seja, menos relacionada à água do que a cristalina.
Propriedades quimicas
O SiOdois o A sílica é essencialmente inerte para a maioria das substâncias, é muito pouco reativa.
Resiste ao ataque de cloro Cldois, bromo bromodois, hidrogênio Hdois e da maioria dos ácidos à temperatura ambiente ou ligeiramente superior. É atacado pelo flúor Fdois, ácido fluorídrico HF e álcalis, como carbonato de sódio NadoisCO3.
O SiOdois Pode combinar-se com elementos metálicos e óxidos para formar silicatos. Se a sílica for fundida com carbonatos de metal alcalino a cerca de 1300 ° C, os silicatos alcalinos são obtidos e o CO é liberado.dois.
Não é combustível. Possui baixa condutividade térmica.
Presença na natureza
A principal fonte de sílica na natureza é a areia.
O SiOdois ou a sílica está na forma de três variedades cristalinas: quartzo (a mais estável), tridimita e cristobalita. As formas amorfas de sílica são ágata, jaspe e ônix. Opala é uma sílica hidratada amorfa.
Existe também a chamada sílica biogênica, ou seja, aquela gerada por organismos vivos. As fontes deste tipo de sílica são bactérias, fungos, diatomáceas, esponjas do mar e plantas.
As partes duras e brilhantes do bambu e da palha contêm sílica, e os esqueletos de alguns organismos marinhos também têm uma alta proporção de sílica; no entanto, as mais importantes são as terras diatomáceas.
Terras diatomáceas são produtos geológicos de organismos unicelulares em decomposição (algas).
Outros tipos de sílica natural
Na natureza, também existem as seguintes variedades:
- Sílica vítrea que são vidros vulcânicos
- Os lechaterielitos que são vidros naturais produzidos pela fusão de material silicioso sob o impacto de meteoritos
- Sílica fundida que é sílica aquecida até a fase líquida e resfriada sem permitir que se cristalize
Obtendo
A sílica das areias é obtida diretamente das pedreiras.

A diatomita ou terra de diatomácea também é obtida dessa forma, por meio de escavadeiras e equipamentos semelhantes..
A sílica amorfa é preparada a partir de soluções aquosas de silicato de metal alcalino (como Na de sódio) por neutralização com ácido, como ácido sulfúrico HdoisSW4, ácido clorídrico HCl ou dióxido de carbono COdois.
Se o pH final da solução for neutro ou alcalino, obtém-se sílica precipitada. Se o pH for ácido, a sílica gel é obtida.
A sílica pirogênica é preparada pela combustão de um composto de silício volátil, geralmente tetracloreto de silício SiCl4. A sílica precipitada é obtida a partir de uma solução aquosa de silicatos à qual o ácido é adicionado.
A sílica coloidal é uma dispersão estável de partículas de tamanho coloidal de sílica amorfa em uma solução aquosa.
Formulários
Em várias aplicações
Sílica ou SiOdois Tem uma grande variedade de funções, por exemplo, serve como abrasivo, absorvente, antiaglomerante, enchimento, opacificante e para promover a suspensão de outras substâncias, entre muitos outros modos de utilização..
É usado por exemplo:
-Na fabricação de vidros, cerâmicas, refratários, abrasivos e vidros de água
-Descoloração e purificação de óleos e produtos petrolíferos
-Em moldes de fundição
-Como um agente antiaglomerante para pós de todos os tipos
-Como um antiespumante
-Para filtrar líquidos, como solventes de lavagem a seco, água de piscina e águas residuais municipais e industriais
-Na fabricação de isolamento térmico, tijolos retardadores de fogo e materiais de embalagem resistentes ao fogo e ácido
-Como enchimento na fabricação de papel e papelão, para torná-los mais resistentes
-Como um enchimento de tinta para melhorar o fluxo e a cor
-Em materiais para polir metais e madeira, pois confere abrasividade a eles
-Em laboratórios de análises químicas em cromatografia e como absorvente
-Como um agente antiaglomerante em fórmulas inseticidas e agroquímicas, para ajudar a triturar pesticidas cerosos e como um transportador do composto ativo
-Como um suporte de catalisador
-Como enchimento para reforçar borrachas sintéticas e borrachas
-Como transportador de fluido na alimentação animal
-Em tintas de impressão
-Como dessecante e adsorvente, na forma de sílica gel
-Como aditivo em cimento
-Como maca de estimação
-Em isoladores para microeletrônica
-Em interruptores termo-ópticos

Na industria alimentícia
A sílica amorfa é incorporada a uma variedade de produtos alimentícios como um ingrediente multifuncional direto em vários tipos de alimentos. Não deve exceder 2% do alimento acabado.
Por exemplo, ele serve como um agente anti-aglomerante (para evitar que certos alimentos grudem), como um estabilizador na produção de cerveja, como um anti-precipitante, para filtrar vinho, cerveja e sucos de frutas ou vegetais.

Ele atua como um absorvente de líquidos em alguns alimentos e um componente de microcápsulas para óleos aromatizantes.
Além do SiOdois Amorfo é aplicado por meio de um processo especial na superfície dos plásticos de artigos de embalagem de alimentos, atuando como uma barreira.
Na industria farmacêutica
É adicionado como um agente antiaglomerante, espessante, gelificante e como um excipiente, ou seja, como um auxiliar para comprimidos de vários medicamentos e vitaminas.
Na indústria de cosméticos e cuidados pessoais
É usado em uma infinidade de produtos: em pós para o rosto, sombras, delineadores de olhos, batons, blushes, removedores de maquiagem, pós, pós para os pés, tinturas de cabelo e alvejantes.
Também em óleos e sais de banho, banhos de espuma, cremes para as mãos e corpo, hidratantes, desodorantes, cremes ou máscaras faciais (exceto cremes de barbear), perfumes, loções e cremes de limpeza.
Também em cremes de hidratação noturna, esmaltes e brilhos, loções refrescantes para a pele, tonificantes para o cabelo, pasta de dente, condicionadores de cabelo, géis e cremes bronzeadores.
Em aplicações terapêuticas
O SiOdois Está presente em vidros bioativos ou biovidros cuja principal característica é poder reagir quimicamente com o ambiente biológico que os rodeia, formando um vínculo forte e duradouro com o tecido vivo..
Esse tipo de material é usado para fazer substitutos ósseos, como os da face, como "suportes" nos quais as células ósseas crescerão. Eles mostraram boa biocompatibilidade com ossos e tecidos moles.
Estes biovidros permitirão recuperar ossos do rosto a pessoas que os perderam por acidente ou doença.
Riscos
Partículas de sílica muito finas podem ser transportadas pelo ar e formar poeiras não explosivas. Mas essa poeira pode irritar a pele e os olhos. A inalação causa irritação do trato respiratório.
Além disso, a inalação de pó de sílica causa danos progressivos a longo prazo aos pulmões, chamados silicose..
Referências
- NÓS. Biblioteca Nacional de Medicina. (2019). Dióxido de silício. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Química Inorgânica Avançada. Quarta edição. John Wiley & Sons.
- Da Silva, M.R. et al. (2017). Técnicas de extração verde. Sorbentes à base de sílica. Em Comprehensive Analytical Chemistry. Recuperado de sciencedirect.com.
- Ylänen, H. (editor). (2018). Vidros bioativos: materiais, propriedades e aplicações (segunda edição). Elsevier. Recuperado de books.google.co.ve.
- Windholz, M. et al. (editores) (1983) The Merck Index. An Encyclopedia of Chemicals, Drugs and Biologicals. Décima edição. Merck & CO., Inc.
- Mäkinen, J. e Suni, T. (2015). Wafers de SOI de Filme Espesso. In Handbook of Silicon Based MEMS Materials and Technologies (Second Edition). Recuperado de sciencedirect.com.
- Sirleto, L. et al. (2010). Interruptores termo-ópticos. Nanocristais de silício. Recuperado de sciencedirect.com.



Ainda sem comentários